一、临床试验组长单位及参加单位
1、临床试验组长单位
2019-2021年中国登记的药物临床试验中,北京市临床试验机构作为组长单位参加临床试验的次数最多,占比依次为19.1%、19.1%、21.0%;其次是上海,作为组长单位参加临床试验的次数占比分别为14.0%、、12.0%、14.6%;第三是江苏,作为组长单位参加临床试验的次数占比分别为8.1%、10.0%、9.8%;第四、第五分别为湖南、广东,2021年作为组长单位参加临床试验的次数占比分别为6.8%、4.9%。
2019-2021年中国临床试验组长单位占比TOP4省市
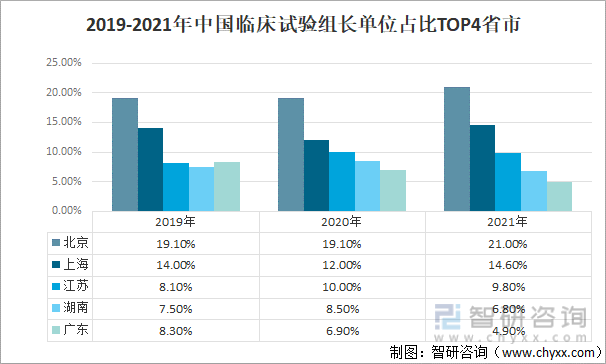
资料来源:国家药审中心、智研咨询整理
2021年,中国全部药物临床试验共涉及国内外临床试验单位40397次(如1个临床试验单位同时作为多项临床试验的参加单位,则按其参加临床试验的次数分别统计一次),其中:中国国内(包括港澳台)参加单位共计25832次,占63.9%;国外参加机构有14565次,占36.1%。
2021年国内外参加机构参与临床试验的次数
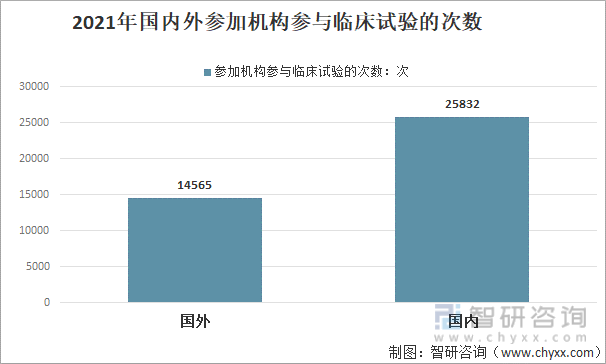
资料来源:国家药审中心、智研咨询整理
2019-2021国内外参加机构的占比情况
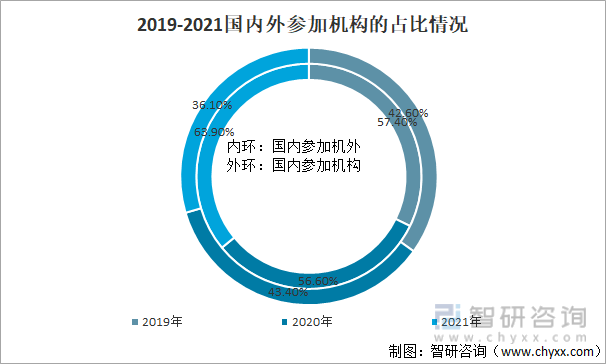
资料来源:国家药审中心、智研咨询整理
相关报告:智研咨询发布的《2022-2028年中国创新药行业竞争格局分析及市场前景趋势报告》
2021年国内(包括港澳台)新药临床试验单位排名全国前三的省市分别为北京、广东、江苏,参加机构参与临床试验的次数分别为2421次、2109次、1996次。上海、浙江、湖南、河南、山东、湖北均超过1000次。
2021年中国国内各省、区、市参加机构参与临床试验的次数
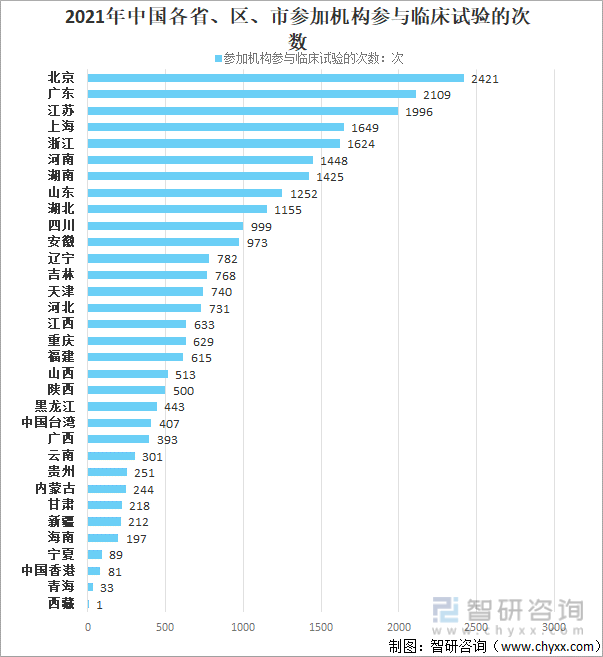
资料来源:国家药审中心、智研咨询整理
二、临床试验耗时及受试者招募情况
1、启动临床试验耗时分析
2021年在已登记的819项国内有效首例受试者知情同意书(ICF)日期且无相关登记号信息(即排除2021年以前获批但在2021年新增试验等其他情形),根据ICF日期和临床试验获批日期计算临床试验启动耗时,时间范围为3天-91个月,平均值为12.2个月。
2021年中国新药临床试验启动耗时情况(按以受理号登记的新药临床试验统计)
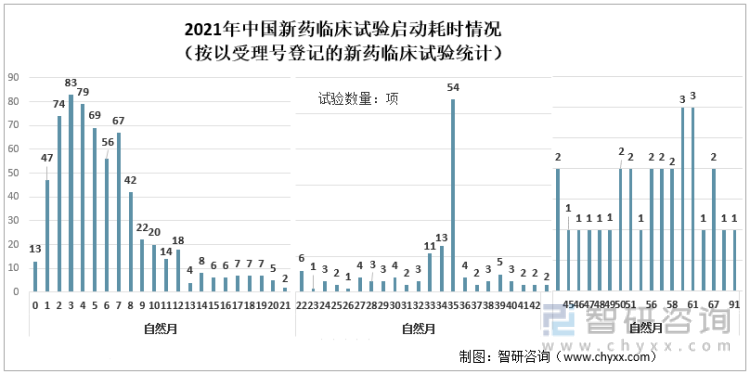
资料来源:国家药审中心、智研咨询整理
从2021年中国新药临床试验总体启动耗时占比来看,新药临床试验总体启动耗时在1-6个月(含)的占51.4%;7-12个月(含)的占22.3%;1-3年的占20.6%;大于3年的占5.6%,可以看出一半以年的试验在6个月内启动受试者招募。
2021年中国新药临床试验总体启动耗时占比情况
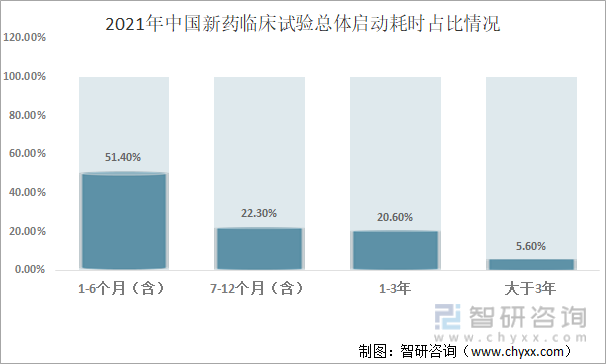
资料来源:国家药审中心、智研咨询整理
2021年,中国化学药在1-6个月(含)启动受试者招募的比例为51.20%,在7-12个月(含)启动受试者招募的比例为26.10%,在1-3年启动受试者招募的比例明为15.90%,大于3年启动受试者招募的比例为6.90%;生物制品在1-6个月(含)启动受试者招募的比例为58.10%,在7-12个月(含)启动受试者招募的比例为20.50%,在1-3年启动受试者招募的比例明为17.40%,大于3年启动受试者招募的比例为4.00%;中药在1-6个月(含)启动受试者招募的比例为2.20%,在7-12个月(含)启动受试者招募的比例为2.20%,在1-3年启动受试者招募的比例明为89.10%,大于3年启动受试者招募的比例为6.50%。
2021年,中国不同药物类型新药临床试验启动耗时占比
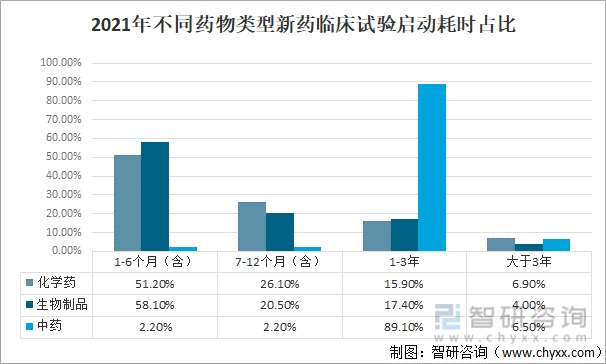
资料来源:国家药审中心、智研咨询整理
2、试验获批后启动受试者招募情况
从2021年中国新药注册临床试验获批后启动受试者招募情况来看,试验获批后启动受试者招募项目378项,平均启动时间3.8月,6个月内启动招募的比例为85.7%。
2019-2021年中国新药注册临床试验获批后启动受试者招募情况
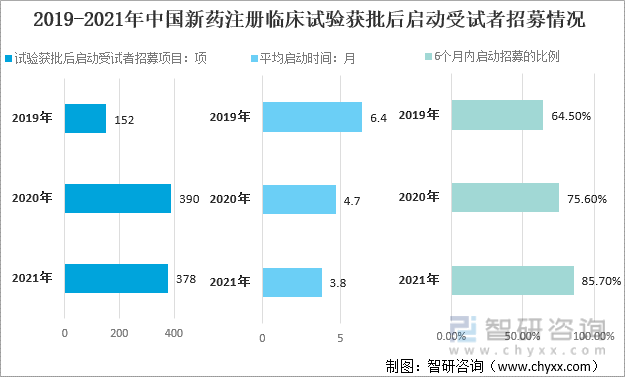
资料来源:国家药审中心、智研咨询整理
三、临床试验完成情况分析
2021年以受理号登记的2033项新药临床试验中,已完成108项,其中:化学药物有91项,包括I期81项;II期 2项;III期5项;其他3项。生物制品有15项,包括I期13项;IV期 1项;其他1项。中药有2项,I期、II期各1项。
2021年新药临床试验完成情况及试验分期(单位:项)
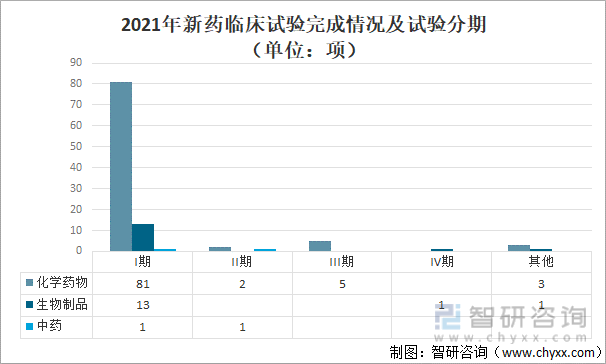
资料来源:国家药审中心、智研咨询整理
2021年,中国新药完成不同分期临床试验的耗时情况来看,I期临床试验的耗时74.1天;II期临床试验的耗时111天;III期临床试验的耗时157.3天;IV期临床试验的耗时244天;其他临床试验的耗时107天。
2021年中国新药完成不同分期临床试验的耗时情况
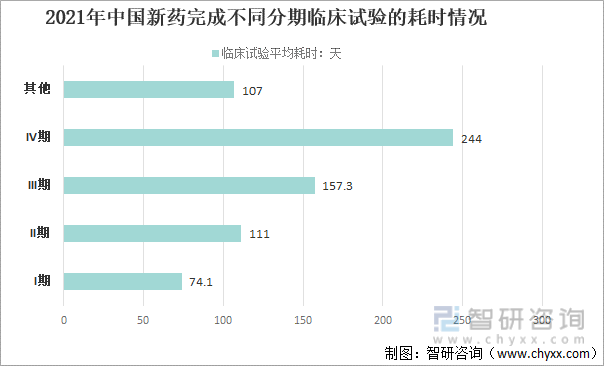
资料来源:国家药审中心、智研咨询整理
2021年中国新药暂停项目6项,其中:中药、化学药各1项,生物制品有4项,主动终止项目共18项,其中:化学药14项,生物制品4项。
2021年中国各类型新药暂停或终止项目数及原因
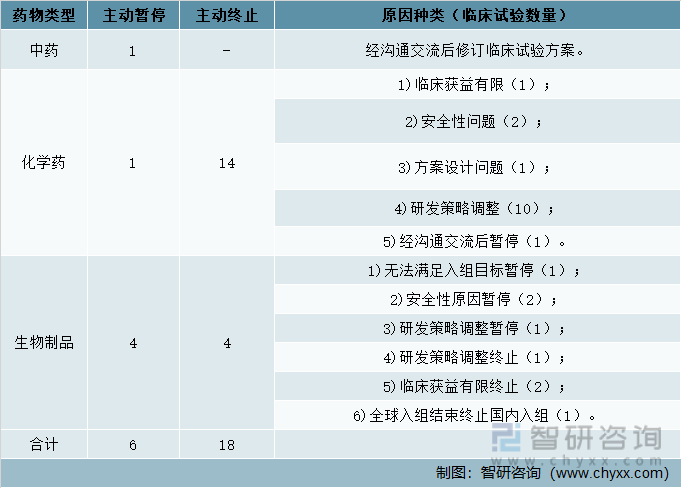
资料来源:国家药审中心、智研咨询整理
近三年数据分析,在当年完成临床试验中,主要以化学药Ⅰ期临床试验为主,2019年-2021年占比分别为69.6%、61.2%和75.0%;按试验分期分析完成时间,Ⅰ期临床试验耗时相对较少,范围为74.1天-95.7天。2021年暂停和终止试验总量明显高于2019年和2020年,暂停和终止原因中因研发策略调整因素占50%(12vs.24);按试验分期分析,37.5%(9vs.24)的试验在Ⅰ期阶段主动终止,占比最高;此外,有12.5%(3vs.24)试验在Ⅲ期阶段主动终止,其中包含1项中期分析结果未获得阳性结果。
以上数据及信息可参考智研咨询(www.chyxx.com)发布的《2022-2028年中国创新药行业竞争格局分析及市场前景趋势报告》。智研咨询是中国领先产业咨询机构,提供深度产业研究报告、商业计划书、可行性研究报告及定制服务等一站式产业咨询服务。您可以关注【智研咨询】公众号,每天及时掌握更多行业动态。
 智研咨询 - 精品报告
智研咨询 - 精品报告

2026-2032年中国小分子创新药行业市场竞争格局及发展前景研判报告
《2026-2032年中国小分子创新药行业市场竞争格局及发展前景研判报告》共九章,包含2021-2025年中国小分子创新药行业竞争格局分析,主要小分子创新药企业或品牌竞争分析,2026-2032年中国小分子创新药行业发展前景预测等内容。

 公众号
公众号
 小程序
小程序
 微信咨询
微信咨询























