2018年8月SANOFI PASTEUR S.A.批签发产品共2078317支,其中吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗批签发1098385支,脊髓灰质炎灭活疫苗批签发979932支。
2018年8月SANOFI PASTEUR S.A.生物制品批签发产品情况
生产企业 | 产品名称 | 规格 | 批号 | 签发量 | 签发结论 |
SANOFI PASTEUR S.A. | 脊髓灰质炎灭活疫苗 | 0.5ml/支。本品每1次人用剂量为0.5ml,含有脊髓灰质炎病毒1型40DU、脊髓灰质炎病毒2型8DU、脊髓灰质炎病毒3型32DU。 | P3M991M | 213355支 | 予以签发 |
SANOFI PASTEUR S.A. | 脊髓灰质炎灭活疫苗 | 0.5ml/支。本品每1次人用剂量为0.5ml,含有脊髓灰质炎病毒1型40DU、脊髓灰质炎病毒2型8DU、脊髓灰质炎病毒3型32DU。 | P3K721M | 438101支 | 予以签发 |
SANOFI PASTEUR S.A. | 脊髓灰质炎灭活疫苗 | 0.5ml/支。本品每1次人用剂量为0.5ml,含有脊髓灰质炎病毒1型40DU、脊髓灰质炎病毒2型8DU、脊髓灰质炎病毒3型32DU。 | P3K711M | 328476支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A711M(DTP-IPV P3N84,Hib P1C96) | 92860支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A681M(DTP-IPV P3N84,Hib P1C10) | 43157支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A741M(DTP-IPV P3N84,Hib P1A08) | 58215支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A701M(DTP-IPV P3N84,Hib P1C95) | 104898支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A141M(DTP-IPV P3K86,Hib P1C08) | 63570支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A131M(DTP-IPV P3K86,Hib P1B96) | 104595支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A651M(DTP-IPV P3M72,Hib P1A70) | 75135支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A101M(DTP-IPV P3K86,Hib P1A67) | 106032支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A631M(DTP-IPV P3M56,Hib P1A63) | 50845支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A661M(DTP-IPV P3M72,Hib P1C69) | 68285支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A191M(DTP-IPV P3L93,Hib P1C09) | 91259支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A691M(DTP-IPV P3N84,Hib P1C94) | 105178支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A641M(DTP-IPV P3M56,Hib P1A68) | 65580支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A671M(DTP-IPV P3M56,Hib P1C10) | 30180支 | 予以签发 |
SANOFI PASTEUR S.A. | 吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗 | 本品为两个包材包装,其一为百白破脊髓灰质炎疫苗,混悬液,每支0.5ml; 其二为b型流感嗜血杆菌结合疫苗,冻干粉。使用前两者混合。 | R0A151M(DTP-IPV P3K86,Hib P1A68) | 38596支 | 予以签发 |
数据来源:中国食品药品检定研究院,智研咨询整理
2018年8月SANOFI PASTEUR S.A.批签发产品类型占比分布图
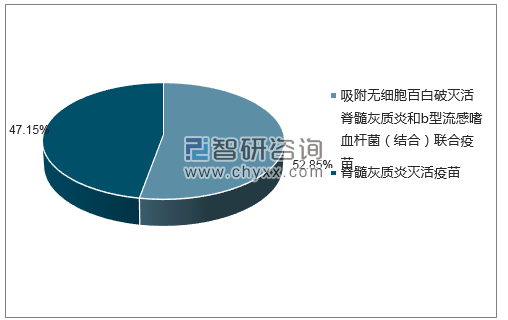
数据来源:中国食品药品检定研究院,智研咨询整理

 公众号
公众号
 小程序
小程序
 微信咨询
微信咨询
























