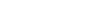普通注射剂无需进行BE试验,杂质、稳定性、无菌性、包材相容性等方面是研究重点。对于口服制剂而言,一致性评价的重点工作是使仿制药与原研药在体内、体外的溶出曲线、速度达到一致,因此需要进行BE试验。但注射剂药物通常直接注入血管,除了特殊注射剂(如脂质体、静脉乳、微球、混悬性注射液、油溶液、胶束等),普通注射剂不存在溶出和吸收的差别,因此不需要进行BE试验。而由于注射剂药物直接注入血管,因此注射剂评价的重要内容是对于其安全性的研究,包括在药品的杂质、稳定性、无菌性和包材的相容性等方面,都需要达到与原研药同样的水平。
政策基本完善,注射剂一致性评价有望加速,申报较早、企业较多的品种有望率先通过。注射剂一致性评价的政策已基本完善。鉴于正式的《技术要求》与2019年的征求意见稿之间差异很小,预计多数已在CDE审评的一致性评价申请(包括存量补充申请+新分类申报)大概率符合相关技术要求,随着审评审批的推进,有望快速通过。其中,申报较早的品种按照审评队列优先顺序有望率先通过,但不排除部分申报较早的品种由于技术要求的更新而需补充材料的可能性;申报企业较多的品种可能随着评审人员对其关键技术指标的熟悉掌握而有可能率先通过;其中技术能力强、质量控制好的企业有望一马当先。
2020年5月14日,国家药监局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告(2020年第62号)》,明确:已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。2020年5月14日,国家药品监督管理局药品审评中心发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》
仿制药一致性评价政策
发文时间 | 发文部门 | 发文时间 | 发文部门 | 主要内容 |
2016.05.26 | 国家食品药品监督管理局 | 《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》 | 国食药监[2016]106号 | 对一致性评价的药品目录,研究内容,程序等相关内容进行了规定,进一步推进药品一致性评价。 |
2016.07.01 | 国家食品药品监督管理局 | 《关于研制过程中所需研究用对照药品一次性进口有关事宜的意见》 | 国食药监[2016]120号 | 对于已在中国境外上市但尚未在中国境内批准上市的药品的进口申报和申报内容进行了规定。 |
2016.08.17 | 国家食品药品监督管理局 | 《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》 | 国食药监[2016]120号 | 对化学药品仿制药口服固体制剂质量和疗效一致性评价的申报材料和内容进行了规定。 |
2017.02.07 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价临床有效性试验一般考虑》 | 国食药监[2017]18号 | 对于找不到或无法确定参比制剂的,需开展临床有效性试验的仿制药一致性评价的方法进行了规定。 |
2017.02.17 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改剂型药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改盐基药品评价一般考虑》 | 国食药监[2017]27号 | 对于口服固体制剂中改规格,改剂型和改盐基这三类药品的一致性评价的的方法进行了规定。 |
2017.04.05 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价品种分类指导意见》 | 国食药监[2017]49号 | 为了推动仿制药质量和疗效一致性评价,对药品的品种进行了分类。 |
2017.05.18 | 国家食品药品监督管理局 | 《仿制药质量和疗效一致性评价研究现场核查指导原则》《仿制药质量和疗效一致性评价生产现场检查指导原则》《仿制药质量和疗效一致性评价临床试验数据核查指导原则》《仿制药质量和疗效一致性评价有因检查指导原则》 | 国食药监[2017]77号 | 对于仿制药质量和疗效一致性评价中研究现场核查的各个方面内容进行了规定。 |
2017.08.25 | 国家食品药品监督管理局 | 《关于仿制药质量和疗效一致性评价工作有关事项的公告》 | 国食药监[2017]100号 | 对一致性评价工作各环节进行了优化调整。 |
2017.10.08 | 中共中央办公厅,国务院办公厅 | 《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》 | 厅字(2017)42号 | 提出深化改革审评审批制度,鼓励药品医疗器械创新。 |
数据来源:公开资料整理
2019年6月13日,仿制药参比制剂目录第二十一批(2019年第34号)公布,首次加入了注射剂。其中一共233个产品,注射剂有163个,共计69个注射剂药品种类。注射剂参比制剂来源情况只包含两类,其中国内上市的原研药品占比69%。2019年8月27日,仿制药参比制剂目录第二十二批中一共507个产品(2019年第56号),注射剂有239个,共计84个注射剂药品种类。与第二十一批不同的是,未进口药品作为参比制剂占大多数,为65%,国内上市的原研药品23%。此后,CDE又陆续公布了六批含注射剂品种的参比制剂目录。目前八批参比制剂目录共计包含855个注射剂参比制剂,预计已相对齐全。
第二十一批参比制剂制剂来源分布
数据来源:国家食品药品监督管理局局官网、智研咨询整理
第二十二批参比制剂制剂来源分布

数据来源:国家食品药品监督管理局局官网、智研咨询整理
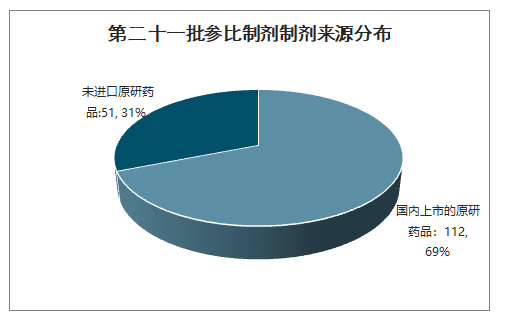
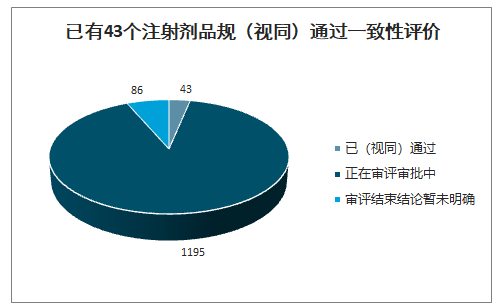
智研咨询发布的《2020-2026年中国注射剂行业市场营销模式及投资规划分析报告》数据显示:截止2020年5月17日,CDE共已受理1324个注射剂一致性评价,其中已有43个申请(视同)通过一致性评价,86个申请审评结束但暂未明确结论,1195个申请正在审评审批中。1195个正在审评审批的申请中,683个为存量注射剂品种的一致性评价补充申请,512个为按照新注册分类标准申报的上市申请。
已有43个注射剂品规(视同)通过一致性评价
数据来源:公开资料整理
正在审评审批的大多为存量品种的一致性评价申请
数据来源:公开资料整理
截至2020年5月17日,注射剂一致性评价,通过企业数量最多的品种为布洛芬、盐酸阿芬太尼、左乙拉西坦注射液等,通过品种数量最多的企业包括四川汇宇、恒瑞医药、人福药业、大冢制药等。目前已经通过的品种主要为按照新3/4类申报生产后获批的注射剂,上市后视同通过一致性评价。同时,少量产品通过补充申请的路径获批,但均是在海外上市、海内外共线的品种。
已(视同)通过注射剂一致性评价企业最多的品种统计

数据来源:公开资料整理
(视同)通过注射剂一致性评价品种最多的企业统计
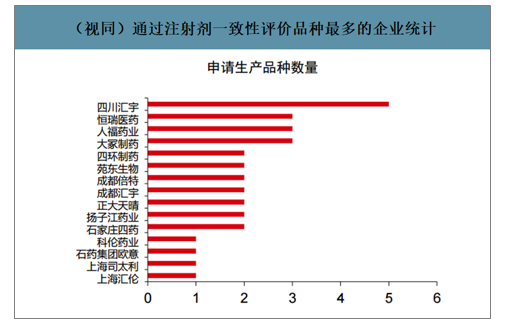
数据来源:公开资料整理
已(视同)申请注射剂一致性评价企业最多的品种统计
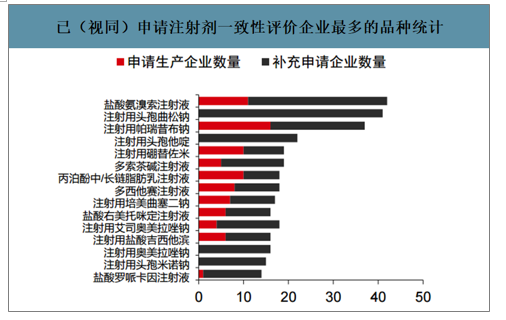
数据来源:公开资料整理
(视同)申请注射剂一致性评价品种最多的企业统计
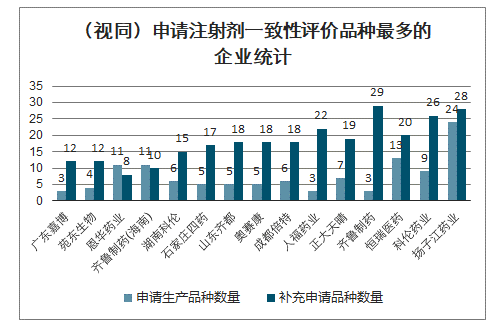
数据来源:公开资料整理
各疾病领域样本医院注射剂金额及占所有剂型比例

数据来源:公开资料整理
 智研咨询 - 精品报告
智研咨询 - 精品报告

2025-2031年中国注射剂行业发展动态及投资规划分析报告
《2025-2031年中国注射剂行业发展动态及投资规划分析报告》共八章,包含新型注射液行业营销模式及策略分析,中国注射剂领先企业案例分析,注射剂行业前景预测与投资建议等内容。

 公众号
公众号
 小程序
小程序
 微信咨询
微信咨询





















![国家对注射剂行业监管日益加强,生物药注射剂行业将成市场发展热点[图]](http://img.chyxx.com/2021/03/20210323134620.jpg?x-oss-process=style/w320)