2017年我国继续积极落实医疗器械审评审批改革措施,完善审评审批体系,并且发布多项政策性文件以此规范我国医疗器械审评审批流程。
2017年,食品药品监管总局共完成医疗器械注册申请技术审评8579项,与2016年相比减少8.1%。其中,首次注册1507项,延续注册5218项,许可事项变更1854项。
2017年,食品药品监管总局共批准医疗器械技术审评注册、延续注册和许可事项变更注册项8923。与2016年相比注册批准总数量增长3.1%。
2017年,食品药品监管总局共对223项医疗器械注册申请不予注册,企业自行撤回331项。
2013-2017年全国医疗器械整体技术审评注册规模及增速

资料来源:国家食品药品监督管理局
2017年,总局批准境内第三类医疗器械注册3300项,与2016年相比增加13.7%,进口医疗器械5623项,与2016年相比减少2.3%。
按照注册品种区分,医疗器械5475项,占全部医疗器械注册数量的61.4%;体外诊断试剂3178项,占全部医疗器械注册数量的35.6%。
按照注册式形区分,首次注册1379项,占全部医疗器械注册数量的15.5%;延续注册5614项,占全部医疗器械注册数量的62.9%;许可事项变更注册1930项,占全部医疗器械注册数量的21.6%。
2017年全国医疗器械注册审评审批格局分布

资料来源:国家食品药品监督管理局
境内第三类医疗器械审评审批注册3300项。其中,医疗器械1910项,体外诊断试剂1390项。
从注册形式看,首次注册813项,占全部境内第三类医疗器械注册数量的24.6%,延续注册1941项,占全部境内第三类医疗器械注册数量的58.8%;许可事项变更546项,占全部境内第三类医疗器械注册数量的16.5%。
境内第三类医疗器械审评审批注册形式分布图
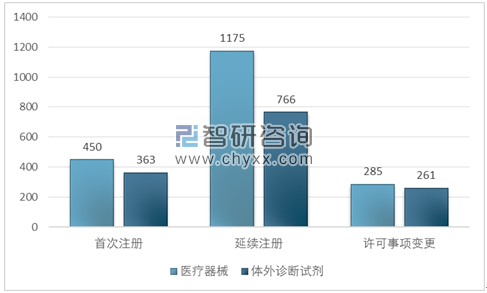
资料来源:国家食品药品监督管理局
进口第二类医疗器械审评审批注册2823项。其中,医疗器械注册1593项,体外诊断试剂注册1230项。
从注册形式看,首次注册375项,占全部进口第二类医疗器械注册数量的13.3%;延续注册1769项,占全部进口第二类医疗器械注册数量的62.6%;许可事项变更679项,占全部进口第二类医疗器械注册数量的24.1%。
进口第二类医疗器械审评审批注册形式分布图

资料来源:国家食品药品监督管理局
3.进口第三类医疗器械审评审批情况
进口第三类医疗器械注册2800项。其中,医疗器械注册2242项,体外诊断试剂注册558项。
从注册形式看,首次注册191项,占全部进口第三类医疗器械注册数量的6.8%;延续注册1904项,占全部进口第三类医疗器械注册数量的68.0%;许可事项变更705项,占全部进口第三类医疗器械注册数量的25.2%。
进口第三类医疗器械审评审批注册形式分布图
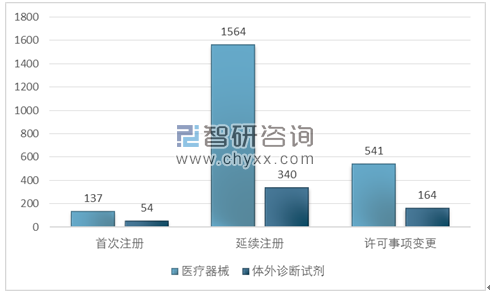
资料来源:国家食品药品监督管理局
2017年,食品药品监管总局共审批批准首次注册医疗器械首次注册共1379项,月度审批情况见图。
2017年度月度审批首次注册医疗器械数据图

资料来源:国家食品药品监督管理局
2017年,注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中25个子目录中产品。
注册数量前五位的境内第三类医疗器械是:医用高分子材料及制品,植入材料和人工器官,注射穿刺器械,医用光学器具、仪器及内窥镜设备,手术室、急救室、诊疗室设备及器具。
与2016年相比,医用高分子材料及制品产品增长56.5%,从第二位跃升至第一位,而植入材料和人工器官产品下降10.5%位居第二位,医用光学器具、仪器及内窥镜设备和注射穿刺器械产品数量与2016年基本持平,手术室、急救室、诊疗室设备及器具产品虽增长24.3%,但仍然位居第五位。
境内第三类医疗器械审评审批注册品种排位图

资料来源:国家食品药品监督管理局
2017年,注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中40个子目录中产品。
注册数量前五位的进口医疗器械,主要是:植入材料和人工器官,医用光学器具、仪器及内窥镜设备,口腔科材料,医用高分子材料及制品,医用电子仪器设备。
与2016年相比,虽然植入材料和人工器官类产品仍位居第一位,但同比下降5.1%,医用高分子材料及制品,医用电子仪器设备均有下降,而口腔科材料产品上升幅度较大,取代了手术室、急救室、诊疗室设备及器具进入前五位。
进口医疗器械审评审批注册品种排位图
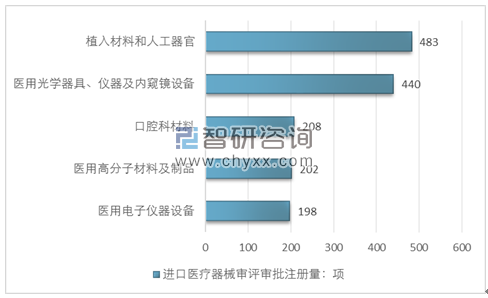
资料来源:国家食品药品监督管理局
从2017年境内第三类医疗器械注册情况看,相关注册产品生产企业主要集中在沿海经济较发达省份。
根据智研咨询发布的《2019-2025年中国康复医疗器械行业市场运营态势及发展前景预测报告》数据显示:北京、江苏、广东、上海、浙江是境内第三类医疗器械注册数量排前五名的省份,占2017年境内第三类医疗器械注册数量的66.7%。
境内第三类医疗器械审评审批注册省份排位图

资料来源:国家食品药品监督管理局
 智研咨询 - 精品报告
智研咨询 - 精品报告

2024-2030年中国微创医疗手术器械行业市场竞争格局及投资前景研判报告
《2024-2030年中国微创医疗手术器械行业市场竞争格局及投资前景研判报告》共十章,包含2019-2023年中国微创医疗手术器械行业竞争格局分析,中国微创医疗手术器械重点企业深度分析,2024-2030年中国微创医疗手术器械行业发展前景及趋势预测分析等内容。
文章转载、引用说明:
智研咨询推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源(智研咨询)。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
智研咨询倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。






