一、药品注册申请
药品注册,是指国家食品药品监督管理局根据药品注册申请人的申请,依照法定程序,对拟上市销售的药品的安全性、有效性、质量可控性等进行系统评价,并决定是否同意其申请的审批过程。
药品注册申请的类别

资料来源:智研咨询整理
二、药品注册申请审评审批现状
1、药品注册申请审评审批相关政策法规
新药研发是激发药品产业发展的重要源动力,国家陆续出台了系列药品审评审批制度的改革政策以鼓励药物创新,尤其新版《药品管理法》强调药品全生命周期管理,将研制与注册独立成为专章,建立上市许可持有人制度,极大强化了新药研发环节。
药品注册申请审评审批相关政策法规
日期 | 颁布部门 | 行业政策法规 | 概述 |
2017年 | 食品药品监管总局 | 《关于鼓励药品创新实行优先审评审批的意见食药监药化管〔2017〕126号》 | 为加强药品注册管理,加快具有临床价值的新药和临床急需仿制药的研发上市,解决药品注册申请积压的矛盾。 |
2017年 | 国家药品监督管理局 | 《关于发布药品注册受理审查指南(试行)的通告(2017年第194号)》 | 为落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),根据《关于调整药品注册受理工作的公告》(2017年第134号)要求,国家食品药品监督管理总局组织制定了药品注册受理审查指南(试行)。 |
2017年 | 食品药品监管总局 | 《关于调整药品注册受理工作的公告(2017年第134号)》 | 依据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),为建立审评主导的药品注册技术体系,实现以审评为核心,现场检查、产品检验为技术支持的审评审批机制,国家食品药品监督管理总局研究决定自2017年12月1日起,将现由省级食品药品监督管理部门受理、国家食品药品监督管理总局审评审批的药品注册申请,调整为国家食品药品监督管理总局集中受理。 |
2018年 | 国家药品监督管理局、国家卫生健康委员 | 《关于临床急需境外新药审评审批相关事宜的公告(2018年第79号)》 | 为落实国务院常务会议有关会议精神,加快临床急需的境外上市新药审评审批,国家药品监督管理局会同国家卫生健康委员会组织起草了《临床急需境外新药审评审批工作程序》及申报资料要求。 |
2018年 | 国家药品监督管理局 | 《关于调整药物临床试验审评审批程序的公告(2018年第50号)》 | 为鼓励创新,加快新药创制,满足公众用药需求,落实申请人研发主体责任,依据中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),对药物临床试验审评审批的有关事项作出调整:在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心(以下简称药审中心)否定或质疑意见的,可按照提交的方案开展药物临床试验。 |
2018年 | 国家药品监督管理局 | 《关于发布古代经典名方中药复方制剂简化注册审批管理规定的公告(2018年第27号)》 | 为贯彻落实《中华人民共和国中医药法》《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),传承发展中医药事业,国家药品监督管理局会同国家中医药管理局组织制定了《古代经典名方中药复方制剂简化注册审批管理规定》。 |
2018年 | 国家药品监督管理局、国家卫生健康委员 | 《关于优化药品注册审评审批有关事宜的公告(2018年第23号)》 | 为贯彻落实《中共中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)、《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),提高创新药上市审批效率,科学简化审批程序。进一步落实药品优先审评审批工作机制,对防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品,国家食品药品监督管理总局药品审评中心(以下简称药审中心)建立与申请人之间的沟通交流机制,加强对药品研发的指导,对纳入优先审评审批范围的注册申请,审评、检查、审批等各环节优先配置资源,加快审评审批。 |
2018年 | 国家药品监督管理局 | 《关于发布《关于加强药品审评审批信息保密管理的实施细则》的通告(2018年第27号)》 | 为维护药品注册申请人的合法权益,规范和加强审评审批信息保密管理,确保药品审评审批工作合法高效运行,根据《中华人民共和国药品管理法》《中共中央办公厅国务院办公厅印发〈关于深化审评审批制度改革鼓励药品医疗器械创新的意见〉的通知》《国家食品药品监督管理总局药品医疗器械审评审批信息保密管理办法》等,国家药品监督管理局制定了《关于加强药品审评审批信息保密管理的实施细则》。 |
2018年 | 国家药品监督管理局 | 《关于加强化学仿制药注射剂注册申请现场检查工作的公告(2018年第20号)》 | 自本公告发布之日起,对已由省级药品监管部门受理并正在国家药品监督管理局审评审批的化学仿制药注射剂注册申请,国家药品监督管理局将加大有因检查的力度,国家食品药品监督管理总局药品审评中心(以下简称药审中心)在严格审评的基础上,根据审评需要提出现场检查需求,由国家食品药品监督管理总局食品药品审核查验中心(以下简称核查中心)实施现场检查。 |
2019年 | 全国人民代表大会常务委员会 | 《中华人民共和国药品管理法》 | 为了加强药品管理,保证药品质量,保障公众用药安全和合法权益,保护和促进公众健康,制定本法。 |
2019年 | 国家药监局 | 《关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年第56号)》 | 为落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,原食品药品监管总局发布了《关于调整原料药、药用辅料和药包材审评审批事项的公告》(2017年第146号),现就进一步明确原料药、药用辅料、直接接触药品的包装材料和容器(以下简称原辅包)与药品制剂关联审评审批和监管有关事宜公告。 |
2020年 | 国家市场监督管理总局 | 《药品注册管理办法》 | 为规范药品注册行为,保证药品的安全、有效和质量可控,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国中医药法》、《中华人民共和国疫苗管理法》(以下简称《疫苗管理法》)、《中华人民共和国行政许可法》、《中华人民共和国药品管理法实施条例》等法律、行政法规,制定本办法。 |
2、审评审批完成情况
智研咨询发布的《2021-2027年中国药品行业发展现状分析及投资策略研究报告》显示:2020年国家药审中心完成中药(包括民族药,下同)、化学药、生物制品各类注册申请审评审批共11582件(含器械组合产品4件,以受理号计,下同),较2019年增长32.67%(如无说明,以注册申请件数计,下同)。其中,完成需技术审评的注册申请8606件(含5674件需药审中心技术审评和行政审批注册申请),较2019年增长26.24%;完成直接行政审批(无需技术审评,下同)的注册申请2972件。
2016-2020年中国药品注册申请审评审批完成情况(单位:件)
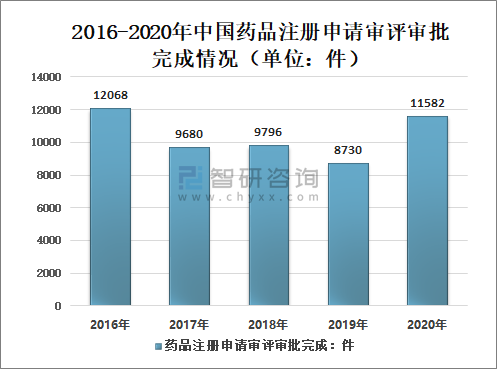
资料来源:国家药审中心、智研咨询整理
2020年国家药审中心完成8606件需技术审评的药品注册申请,同比增长26.24%,其中:化学药注册申请为6778件,较2019年增长25.22%;中药注册申请418件,较2019年增长39.33%;生物制品注册申请1410件,较2019年增长27.72%;化学药注册申请约占全部技术审评完成量的78.76%。
2016-2020年中国药品注册申请需技术审评完成情况(单位:件)

资料来源:国家药审中心、智研咨询整理
2016-2020年中国中药、生物制品、化学药注册申请审评审批完成情况(单位:件)
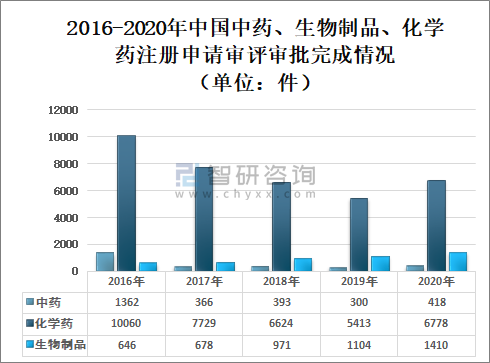
(注:1.完成总量中包含器械组合产品的注册申请,故注册申请完成总量大于中药、化学药、生物制品注册申请完成量之和。2.药审中心的直接行政审批工作自2017年开始,故2016年无直接行政审批的注册申请,2016年的注册申请均需技术审评。)
资料来源:国家药审中心、智研咨询整理
3、各类注册申请审评完成情况
药审中心完成需技术审评的8606件注册申请中,完成新药临床试验(IND)申请审评1561件,较2019年增长55.94%;完成新药上市申请(NDA)审评289件,完成仿制药上市申请(ANDA)审评1700件;完成仿制药质量和疗效一致性评价(以下简称一致性评价)申请(以补充申请途径申报)1136件,较2019年增长103.22%;完成补充申请技术审评3250件,较2019年增长24.19%;难性临床申请审评126件,较2019年增长0.8%;补充申请审评完成3250件,较2019年增长24.19%;境外生产药品再注册申请审评完成498件,较2019年下降10.91%;复审申请审评完成46件,较2019年增长70.37%。
2016-2020年中国各类注册申请审评完成情况(单位:件)
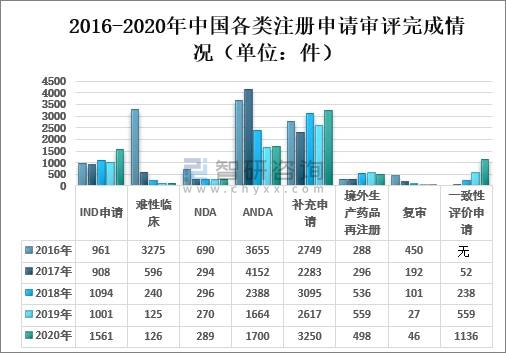
(注:药审中心自2017年8月开始承担仿制药质量和疗效一致性评价工作。)
资料来源:国家药审中心、智研咨询整理
4、审评通过情况
2020年国家药审中心审评通过批准IND申请1435件,较2019年增长54.97%;审评通过NDA208件,较2019年增长26.83%;审评通过ANDA918件;审评通过批准一致性评价申请577件,较2019年增长121.92%。药审中心审评通过创新药NDA20个品种,审评通过境外生产原研药品NDA72个品种(含新增适应症品种)。
2019-2020年中国药审中心审评通过批准IND、NDA、ANDA申请及审评通过批准一致性评价申请(单位:件)
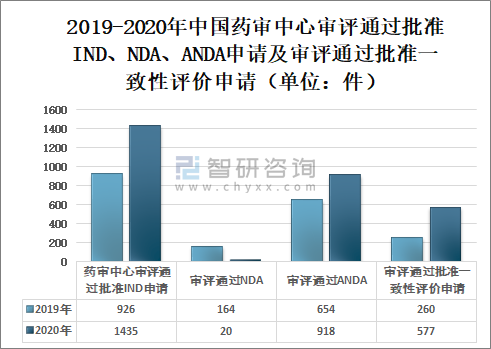
资料来源:国家药审中心、智研咨询整理
5、审结注册申请任务按时限完成情况
2020年国家药审中心持续优化审评流程,严格审评时限管理,加强项目督导,加快审评速度,整体审评任务和重点序列审评任务按时限完成率均取得显著提升。
全年审结注册申请任务整体按时限完成率为94.48%,其中临床急需境外已上市新药注册申请审结任务整体按时限完成率为100%;按默示许可受理注册申请的审结任务整体按时限完成率为99.87%;直接行政审批的注册申请100%在法定的20个工作日内完成,且审批平均用时11.8个工作日;临床急需境外已上市新药审结任务整体按时限完成率100%;境外生产药品再注册审结任务整体按时限完成率97.99%;补充申请审结任务整体按时限完成率96.94%;一致性评价申请审结任务整体按时限完成率89.01%;ANDA审结任务整体按时限完成率76.77%;优先审评审结任务整体按时限完成率72.87%;NDA审结任务整体按时限完成率55.50%。
2020年中国各类注册申请任务按时限完成情况
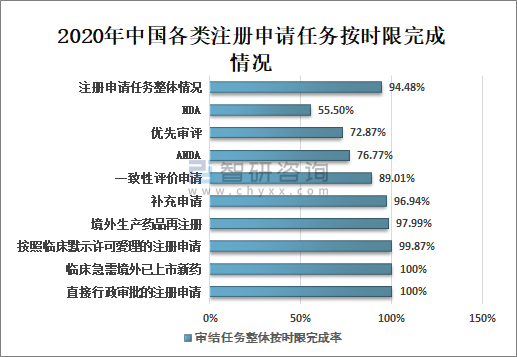
资料来源:国家药审中心、智研咨询整理
三、药品注册申请受理情况
1、药品注册申请受理
2016-2020年国家药审中心药品注册申请受理数量呈增长态势,2020年中国药审中心受理中药、化学药、生物制品各类注册申请共10245件(含药械组合产品6件),较2019年增长26.76%。
2016-2020年中国药品注册申请受理情况(单位:件)
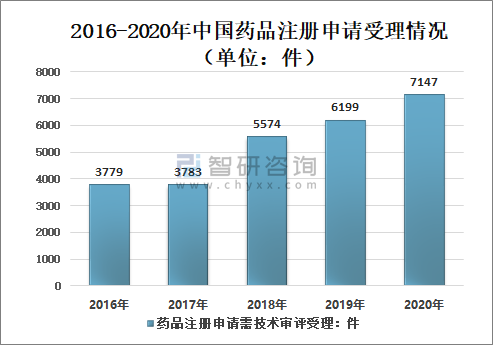
资料来源:国家药审中心、智研咨询整理
其中,需技术审评的注册申请7147件(含5695件需药审中心技术审评和行政审批的注册申请),较2019年增长15.29%。
2016-2020年中国药品注册申请需技术审评受理情况(单位:件)
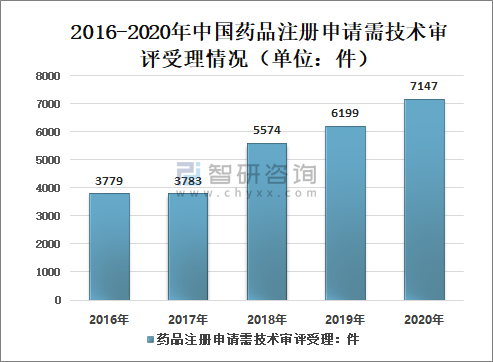
资料来源:国家药审中心、智研咨询整理
2020年国家药审中心受理的10239件药品注册申请中,化学药注册申请受理量为7901件,较2019年增长22.02%,占2020年全部注册申请受理量的77.17%;中药注册申请受理量为471件,较2019年增长11.35%,占2020年全部注册申请受理量的4.60%;生物制品注册申请受理量为1867件,较2019年增长58.35%,占2020年全部注册申请受理量的18.23%;
2016-2020年中国各类药品注册申请受理情况(单位:件)
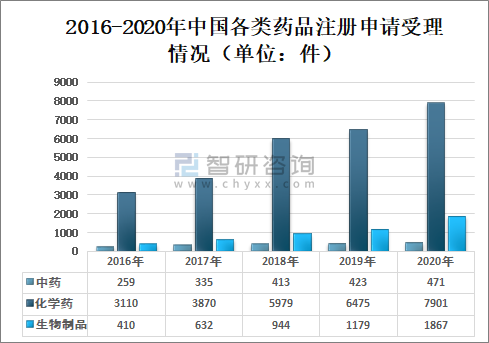
(注:1.2019-2020年受理量中含药械组合产品的注册申请,故上图中2019-2020年受理注册申请总量大于中药、化学药、生物制品受理注册申请之和;2.药审中心的直接行政审批工作自2017年开始,故2016年无直接行政审批注册申请,所有受理注册申请均需技术审评。)
资料来源:国家药审中心、智研咨询整理
2020年国家药审中心受理的需技术审评的注册申请7147件中,化学药注册申请为5402件,较2019年增长9.42%,占全部需技术审评的注册申请受理量的75.58%;中药注册申请315件,较2019年增长22.57%;生物制品注册申请1430件,较2019年增长42.29%。
2016-2020年需技术审评的中药、化学药、生物制品各类药品注册申请受理情况(单位:件)

资料来源:国家药审中心、智研咨询整理
2、行政审批注册申请受理情况
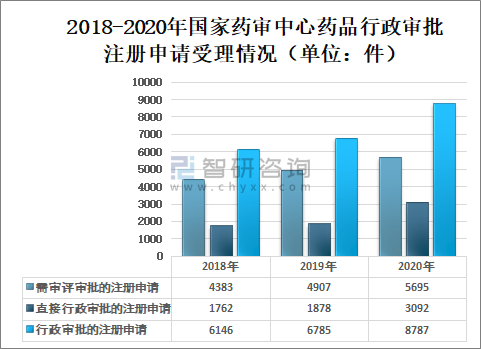
2020年国家药审中心受理需中心行政审批的中药、化学药、生物制品各类注册申请8787件,较2019年增长29.51%。其中,受理需审评审批的注册申请(临床试验申请、一致性评价申请、补充申请、境外生产药品再注册及复审)5695件,较2019年增长16.06%;受理直接行政审批的注册申请(无需技术审评的补充申请、临时进口申请)3092件,较2019年增长64.64%。
2018-2020年国家药审中心药品行政审批注册申请受理情况(单位:件)
资料来源:国家药审中心、智研咨询整理
2020年国家药审中心药品需审评审批的注册申请受理数量5696件,其中:临床试验申请(含验性临床)行政审批注册申请受理1618件;一致性评价申请行政审批注册申请受理914件;补充申请行政审批注册申请受理2827件;境外生产药品再注册行政审批注册申请受理328件;复审行政审批注册申请受理8件。直接行政审批的注册申请受理数量3092件,其中:无需技术审评的补充申请行政审批注册申请受理2644件;临时进口申请行政审批注册申请受理448件。
药审中心受理3092件直接行政审批的注册申请中,按申请类型划分,补充申请2644件、临时进口申请448件。
2020年国家药审中心药品行政审批注册申请受理的具体情况
受理量 | 中药 | 化学药 | 生物制品 | 总计 | |
需审评审批的注册申请受理数量 | 临床试验申请(含验性临床) | 22 | 1016 | 580 | 1618 |
一致性评价申请 | 0 | 914 | 0 | 914 | |
补充申请 | 271 | 1856 | 700 | 2827 | |
境外生产药品再注册 | 11 | 294 | 23 | 328 | |
复审 | 3 | 5 | 0 | 8 | |
直接行政审批的注册申请受理数量 | 无需技术审评的补充申请 | 144 | 2124 | 376 | 2644 |
临时进口申请 | 12 | 375 | 61 | 448 | |
总计 | 463 | 6584 | 1740 | 8787 | |
 智研咨询 - 精品报告
智研咨询 - 精品报告

2024-2030年中国硫酸氢氯吡格雷行业市场全景评估及发展前景研判报告
《2024-2030年中国硫酸氢氯吡格雷行业市场全景评估及发展前景研判报告》共十一章,包含硫酸氢氯吡格雷地区运行分析,硫酸氢氯吡格雷重点企业竞争力分析,2024-2030年中国硫酸氢氯吡格雷行业发展前景预测等内容。
文章转载、引用说明:
智研咨询推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源(智研咨询)。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
智研咨询倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。







