2018年,医疗器械研发、生产和销售领域均有多项政策发布,引导行业健康发展。国家鼓励器械创新的力度不亚于药品,鼓励国产器械进口替代的政策不断出台。政策背景下医疗器械行业维持高景气度,行业将迎来更加健康有序的发展。
在医疗器械研发领域,2018年国家药监局等部门出台了多项政策,包括优化和加快创新器械审批流程、扩大免于进行临床试验的医疗器械目录范围、发布医疗器械临床试验设计指导原则、扩大医疗器械注册人制度试点范围等,积极推进多个器械研发相关指导原则和申报指南的发布,加大力度鼓励器械创新、加强器械研发监管。其中在鼓励器械创新领域,《创新医疗器械特别审查程序》和《创新医疗器械特别审查申报资料编写指南》已发布,有利于提升创新医疗器械审查效率,为鼓励医疗器械产业创新发展发挥了积极作用;《医疗器械监督管理条例修正案(草案送审稿)》有望成为鼓励器械创新的标志性政策,有望于明年正式出台。
2018年医疗器械研发相关政策
年份 | 部门 | 政策 | 简介 |
1月8日 | 国家药监局 | 发布医疗器械临床试验设计指导原则 | 明确了医疗器械临床试验设计的基本类型和特点、受试对象、评价指标等方面的技术指导原则。指导原则适用于产品组成、设计和性能已定型的医疗器械,包括治疗类产品、诊断类产品,不包括体外诊断试剂。 |
1月11日 | 国家药监局 | 接受医疗器械境外临床试验数据技术指导原则 | 提出了接受境外临床试验数据的伦理原则、依法原则和科学原则,明确了境外临床试验数据的资料要求和技术要求。从技术审评要求、受试人群、临床试验条件的差异等方面,阐述了接受境外临床试验资料时的考虑因素及技术要求,并给出了不同因素对临床数据产生有临床意义影响的具体实例。 |
1月30日 | 国家药监局、科技部 | 《食品药品监督管理总局科技部关于加强和促进食品药品科技创新工作的指导意见》 | 推进供给侧结构性改革,在深化改革中切实加强食品药品医疗器械监管科技工作,以创新引领监管水平提升,进而促进食品药品医疗器械行业的创新发展。 |
2月11日 | 国务院 | 关于上海市进一步推进“证照分离”改革试点工作方案的批复 | 推进医疗器械审评审批制度改革,前移技术服务与指导,优化准入路径,提高产品质量,缩短准入周期。对于纳入优先审查通道的医疗器械,在受理之前提供技术服务,并通过实施专家咨询,提前介入指导,全程跟踪服务。加快审查速度,同步开展注册质量体系核查,优化注册质量体系核查现场检查和生产许可证审批的现场检查。 |
3月15日 | 国家药监局 | 《总局办公厅关于印发医疗器械标准化技术委员会考核评估方案的通知》 | 加强对医疗器械标准化技术委员会的管理,提升标准工作水平。 |
4月2日 | 国务院 | 关于在海南博鳌乐城国际医疗旅游先行区暂停实施《医疗器械监督管理条例》有关规定的决定 | 为进一步支持海南省试点发展国际医疗旅游相关产业,下放部分医疗器械审批权限:对先行区内医疗机构临床急需且在我国尚无同品种产品获准注册的医疗器械,由海南省人民政府实施进口批准,在指定医疗机构使用。 |
4月23日 | 国家药监局 | 《关于征集治疗严重危及生命且尚无有效治疗手段疾病及公共卫生方面等临床急需医疗器械相关信息的通知》 | 为更好的启动《临床急需医疗器械审评审批确定程序》相关制定工作,医疗器械技术审评中心面向全社会征求临床急需医疗器械的相关信息。 |
4月25日 | 国家药监局 | 关于公开征求《临床急需医疗器械附带条件批准上市的基本原则(征求意见稿)》意见的通知 | 目的是更好地满足公众对治疗严重危及生命尚无有效治疗手段疾病及公共卫生等临床急需医疗器械的临床需求,促进医疗器械技术创新,基本原则适当平衡上市前数据和上市后数据收集要求的合理性。 |
5月7日 | 国家药监局 | 创新医疗器械特别审批程序(修订稿征求意见稿) | 在过去四年中特别审批程序之实施情况的基础上作出的调整和改进,包括细化特别审批程序的审查要求,明确医疗器械的适用类别,限定适用特别程序审批的医疗器械的注册申请时间等。 |
5月10日 | 科技部 | 《“十三五”生物技术创新专项规划》 | 文件指出,支持生物医学工程与医疗器械发展。突破一批高端大型医疗器械与仪器设备核心零部件开发技术,健全产品评估体系及能力支撑平台,加快发展医学影像设备、医用机器人、新型植入装置、新型生物医用材料、体外诊断技术与产品、可穿戴设备等产品。 |
5月21日 | 国家药监局 | 征求医疗器械延续注册等部分申报资料要求修改意见 | 为简化、优化医疗器械延续注册、临床试验审批、提高审评审批效率,国家药品监督管理局组织对医疗器械延续注册等部分申报资料要求进行了研究,提出修改意见,关于“医疗器械延续注册申报资料要求及说明”和“医疗器械临床试验审批申报资料要求及说明”方面。 |
5月24日 | 国务院 | 《进一步深化中国(广东)、(天津)、(福建)自由贸易试验区改革开放方案》 | 继上海自贸区试点医疗器械注册人制度后,国务院允许广东和天津自贸试验区内医疗器械注册申请人委托省/市内医器械生产企业生产产品,表明医疗器械注册人制度改革步伐加快,后续试点范围有望不断拓展。 |
5月29日 | 国家药监局 | 《国家药品监督管理局办公室关于印发2018年国家医疗器械抽检产品检验方案的通知》 | 要求各级药监局组织相关检验机构按强制性标准以及经注册或者备案的产品技术要求(注册产品标准)开展检验工作。 |
6月1日 | 国家药监局 | 国家药品监督管理局办公室公开征求《医疗器械临床试验检查要点及判定原则(征求意见稿)》意见 | 为强化对医疗器械临床试验过程的监督管理,有效开展医疗器械临床试验监督检查,国家药品监督管理局起草了该意见稿,包括临床试验前准备、受试者权益保障、临床试验方案、临床试验过程、记录与报告、试验用医疗器械体外诊断试剂管理、临床试验用样本的管理(适用体外诊断试剂)。 |
6月11日 | 国家药监局 | 关于征求对《第四批免于进行临床试验医疗器械目录(征求意见稿)》和《前三批免于进行临床试验医疗器械目录(征求意见稿)》意见的通知 | 为进一步规范医疗器械临床评价工作,扩大免于进行临床试验的医疗器械目录范围,医疗器械技术审评中心组织了免于进行临床试验医疗器械产品目录的制修订工作,形成了《第四批免于进行临床试验医疗器械目录(征求意见稿)》,并参照新《医疗器械分类目录》对前三批已经发布的豁免目录进行了修订调整,形成了《前三批免于进行临床试验医疗器械目录修订稿(征求意见稿)》 |
6月25日 | 司法部 | 《医疗器械监督管理条例修正案(草案送审稿)》 | 此次修改的重点内容包括:完善医疗器械上市许可持有人制度、改革临床试验管理制度、优化审批程序、完善上市后监管要求、加强医疗器械监管等。 |
7月10日 | 上海市委、市政府 | 关于将本市医疗器械注册人制度改革试点扩大至全市范围实施的公告 | 将《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》中注册申请人的区域范围扩大至全市,允许上海市范围内的医疗器械注册申请人委托上海市医疗器械生产企业生产产品,医疗器械注册人制度改革再加速。 |
8月3日 | 国家药监局 | 征求《进口医疗器械代理人监督管理办法》意见 | 对代理人的条件和义务以及相应的法律责任都做了明确划定。进口医疗器械监督管理和代理人行为规范从此有专门法律法规可依了。 |
10月18日 | 国家药监局 | 发布用于罕见病防治医疗器械注册审查指导原则 | 规定了罕见病防治医疗器械注册审查的适用范围、沟通交流、临床前研究、免于临床试验基本原则、临床试验基本原则、批准上市条件和其他要求。 |
11月5日 | 国家药监局 | 《创新医疗器械特别审查程序》 | 完善了适用情形、细化了申请流程、提升了创新审查的实效性、完善了审查方式和通知形式,并明确对创新医疗器械的许可事项变更优先办理,有利于提升创新医疗器械审查效率,为鼓励医疗器械产业创新发展发挥积极作用。 |
11月9日 | 国家药监局 | 《国家药监局综合司关于贯彻落实国务院“证照分离”改革要求做好医疗器械上市后监管审批相关工作的通知》 | 要求各省级药监部门加快推进政府职能转变,做到放管结合、放管并重、宽进严管,强化事中事后监管,推动部分医疗器械生产经营企业行政审批事项改革。 |
12月18日 | 国家药监局 | 发布创新医疗器械特别审查申报资料编写指南 | 对申请创新医疗器械的申报资料准备和撰写要求进行了规范,旨在使申请人明确在申报过程中应予关注的重点内容,以期解决申报过程中遇到的一些共性问题。 |
数据来源:公开资料整理
2018年,在医疗器械生产领域的相关政策主要包括发布医疗器械标准规划、多个器械产品享有零部件和原材料免税政策、扩大医疗器械注册人制度试点范围、制定医疗器械唯一标识数据相关标准及规范等,积极推进标准覆盖面、有效性、先进性和适用性的提高,优化器械研发和生产资源的合理配置,促进器械行业生产流通规范高效进行。医疗器械注册人制度允许不具有生产资质的但却有生产能力的企业受托生产产品,推进了行业资源的优化合理配置,2018年改革步伐加快,后续试点范围有望不断拓展。
2018年医疗器械生产相关政策
年份 | 部门 | 政策 | 简介 |
1月29日 | 国家药监局 | 《医疗器械标准规划(2018—2020年)》 | 规划提出到2020年,建成基本适应医疗器械监管需要的医疗器械标准体系。修订医疗器械标准300项,标准覆盖面进一步提升,标准有效性、先进性和适用性显著增强。医疗器械标准制修订更加及时,标准制修订管理更加规范,标准实施与监督进一步强化。 |
5月24日 | 国务院 | 《进一步深化中国(广东)、(天津)、(福建)自由贸易试验区改革开放方案》 | 继上海自贸区试点医疗器械注册人制度后,国务院允许广东和天津自贸试验区内医疗器械注册申请人委托省/市内医器械生产企业生产产品,表明医疗器械注册人制度改革步伐加快,后续试点范围有望不断拓展。 |
5月29日 | 国家药监局 | 国家药品监督管理局办公室关于印发医疗器械注册技术审查指导原则制修订工作管理规范的通知 | 本指导原则用于规范医疗器械注册技术审查、指导医疗器械注册申请人注册申报。适用于指导原则制修订工作的申报立项。编制审校、征求意见、审核发布、修订和废止 |
6月13日 | 国务院 | 召开常务会议 | 目前我国有10个医疗设备产品率先享受到了国家的零部件和原材料免税政策。此次会议提出,要增加有助于转型发展的技术装备进口,预计未来会有更多的医疗器械享受到零部件和原材料免税福利,有助于降低成本,加快国产替代。 |
6月25日 | 司法部 | 《医疗器械监督管理条例修正案(草案送审稿)》 | 此次修改的重点内容包括:完善医疗器械上市许可持有人制度、改革临床试验管理制度、优化审批程序、完善上市后监管要求、加强医疗器械监管等。 |
7月10日 | 上海市委、市政府 | 关于将本市医疗器械注册人制度改革试点扩大至全市范围实施的公告 | 将《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》中注册申请人的区域范围扩大至全市,允许上海市范围内的医疗器械注册申请人委托上海市医疗器械生产企业生产产品,医疗器械注册人制度改革再加速。 |
7月31日 | 国家药监局 | 《关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知》 | 要求各省级药监局做好医疗器械经营许可(备案)信息有关内容调整工作,指定专人负责及时上传医疗器械生产经营许可(备案)信息,并及时对外公开,规范了医疗器械生产经营企业取得生产经营许可的基本信息公开要求。 |
8月22日 | 国家市场监督管理总局 | 公开征求《医疗器械唯一标识系统规则(征求意见稿)》意见 | 制定医疗器械唯一标识数据相关标准及规范,组织建立医疗器械唯一标识数据库,供公众查询。 |
9月30日 | 国家药监局 | 发布《医疗器械生产企业管理者代表管理指南》 | 明确管理者代表的职责,规范管理者代表的管理,确保质量管理体系科学、合理与有效运行。适用于对医疗器械生产企业管理者代表的管理。 |
12月11日 | 国家药监局 | 《2019年医疗器械行业标准制修订计划项目》 | 确定了2019年94项医疗器械行业标准制修订计划项目 |
数据来源:公开资料整理
在医疗器械采购与销售领域,国家一方面加大监管和整治力度,促进器械行业健康发展。国家今年在规范经营方面的合规管控力度有所加强,加大飞检力度,加大商业贿赂的打击力度,将器械网售监管纳入重点,明确了网络销售的范围与第三方平台提供者以及监管部门的责任义务,完善不良事件监测责任制度,行业整体经营环境得到逐步改善。
另一方面放开大型设备配置权限、增加配置数量,加大基层医疗服务能力建设带来新购设备需求,医疗器械行业迎来高景气度;同时通过优秀国产医疗设备遴选等政策鼓励优秀国产设备进口替代,国产医疗器械厂商迎来重要红利期。卫健委下放大型医疗设备配置权限,其中甲类管理目录由12个减至5个,乙类管理目录由5个调整为7个,部分医疗设备无需审批即可配置,有利于促进医疗机构增加配置大型医疗设备。国家推出《提升县级医院综合能力》等一系列发展基层医疗服务的政策,要求从2018年起再实施500家县医院综合能力提升工程,积极推进优质服务示范乡镇卫生院和社区卫生服务中心建设,这一系列政策的实施有望带来医疗设备采购需求的大幅增长。在鼓励进口替代方面,近年来政府多次发文鼓励使用国产医疗器械,国产优秀医疗设备遴选工作已开展四批,有不少国内器械厂商受益;近几年各地积极响应落实鼓励使用国产医疗器械的政策,四川、浙江、湖北等多个省份明确鼓励国产医疗设备的使用,其中今年广东省发布类似政策,明确提出对于国产产品已能满足临床基本使用需求、国产厂商超过三家的产品限制进口。
2018年医疗器械销售相关政策
年份 | 部门 | 政策 | 简介 |
1月17日 | 国务院 | 召开国务院常务会议 | 决定由上海市在浦东新区对医疗等10个领域47项审批事项进行改革试点,推进“照后减证”。其中包括“取消社会办医疗机构乙类大型医用设备配置许可证核发等审批,社会办营利性医疗机构床位数逐步实行自主决定”。 |
2月27日 | 国家药监局 | 《总局办公厅关于实施〈医疗器械网络销售监督管理办法〉有关事项的通知》 | 将器械网售监管纳入重点,明确了网络销售的范围不得超出其生产经营许可或者备案的范围,明确了第三方平台提供者以及监管部门的责任义务,规定网络销售企业必须具有线下实体店。 |
3月20日 | 国家卫计委六部门联合印发 | 《关于巩固破除以药补医成果持续深化公立医院综合改革的通知》 | 首次对高值耗材做出了明确的指示,高值耗材要探索实行打包收费,制定统一医疗服务价格,实行高值医用耗材分类集中采购,逐步推行高值医用耗材购销“两票制”,要求在15市30县先行先试。 |
3月28日 | 卫健委 | 《国家卫生计生委关于印发2018年卫生计生重点工作任务及分工方案的通知》 | 通知要求从2018年起再实施500家县医院综合能力提升工程,推进优质服务示范乡镇卫生院和社区卫生服务中心建设。此政策有望带来新购医疗设备需求。 |
3月29日 | 中国医学装备协会 | 《关于第四批优秀国产医疗设备遴选评审结果(技术参数、企业情况)公示的函》 | 覆盖DR、3.0T磁共振、彩超等12类医械产品,上榜产品有望在医疗设备采购中获得更多的支持。 |
4月9日 | 卫健委 | 大型医用设备配置许可管理目录(2018年) | 下放大型医疗设备配置权限,其中甲类管理目录由12个减至5个,乙类管理目录由5个调整为7个,部分医疗设备无需审批即可配置,有利于促进医疗机构增加配置大型医疗设备。 |
4月11日 | 发改委等8大部委 | 《关于促进首台(套)重大技术装备示范应用的意见》 | 在政府采购中优先、鼓励采购首台套创新产品;纳入首台套目录的产品投标时,招标单位不得对其提出市占率、使用业绩等的要求,不得对其套用特定产品设置评价标准、技术参数等,不得以不合理条件限制或排斥首台套产品参与投标。共有32类医疗器械被列入工信部的《首台(套)重大技术装备推广应用指导目录》。 |
4月26日 | 国家药监局 | 《2018年严厉打击违法违规经营使用医疗器械专项整治工作》 | 严查经营(网络销售)和使用未取得注册证或者备案凭证的医疗器械行为;严查非法经营关注度高、使用量大的注射用透明质酸钠、隐形眼镜等产品行为;严查未经许可(备案)从事经营和王阔销售医疗器械行为。 |
5月29日 | 京津冀三地卫生计生委 | 《关于执行京津冀公立医院第一批医用耗材联合采购结果有关事项的通知》 | 三地第一批医用耗材联合采购结果出炉。包括人工关节类等六大类医用耗材,涉及179家企业申报的32357条产品,整体降幅达到15%,有利于减轻患者医疗费用负担。 |
6月4日 | 北京卫计委、中医药管理局 | 《关于推进和规范卫生计生系统行风建设管理的通知》 | 北京明确规定,要严管医疗设备的捐赠、投放、租赁,严禁捆绑销售等变相采购耗材试剂的行为,以及防止耗材采购价格过高,防止高值耗材滥用。 |
6月13日 | 卫健委 | 《甲类大型医用设备配置许可管理实施细则》、《大型医用设备配置与使用管理办法(试行)》 | 明确了由省级卫生健康行政部门结合本地区医疗卫生服务体系规划,提出本地区大型医用设备配置规划和实施方案建议,国家卫生健康委负责制订大型医用设备配置规划。 |
6月25日 | 司法部 | 《医疗器械监督管理条例修正案(草案送审稿)》 | 此次修改的重点内容包括:完善医疗器械上市许可持有人制度、改革临床试验管理制度、优化审批程序、完善上市后监管要求、加强医疗器械监管等。 |
7月16日 | 广东省卫计委 | 发布了《2018年省级卫生计生机构政府采购医疗器械允许进口和控制进口目录清单》 | 121种医疗器械被列入允许进口的目录清单,55种医疗器械被列入控制进口目录清单。限制进口的器械主要是国产产品已能满足临床基本使用需求、国产厂商超过三家的产品,主要包括3.0T以下MRI、64排以下CT、DR、彩超、麻醉机、监护仪、血细胞分析仪、颤监护仪、心电图机等。 |
8月3日 | 国务院 | 《国务院办公厅关于改革完善医疗卫生行业综合监管制度的指导意见》 | 建立完善高值医用耗材的跟踪监控制度,开展大型医用设备使用监督和评估,依法纠正和处理违法违规使用行为。在医疗器械购销领域,商业贿赂行为将被严厉打击,耗材招标采购政策由国家医保局全权把握。 |
8月22日 | 国家市场监督管理总局 | 公开征求《医疗器械唯一标识系统规则(征求意见稿)》意见 | 制定医疗器械唯一标识数据相关标准及规范,组织建立医疗器械唯一标识数据库,供公众查询。 |
8月23日 | 卫健委等9部委 | 《2018年纠正医药购销领域和医疗服务中不正之风专项治理工作要点》 | 加大耗材飞检力度,探索产品质量终身负责制,规范高值耗材名称和编码,加大商业贿赂的打击力度。 |
8月28日 | 国务院 | 《深化医药卫生体制改革2018年下半年重点工作任务的通知》 | 明确提出由药监局、卫健委、医保局负责推进医疗器械国产化,促进创新产品应用推广,国产医疗器械的进口替代步伐有望进一步加快。制定治理高值医用耗材和过度医疗检查的改革方案。制定医疗器械编码规则,探索实施高值医用耗材注册、采购、使用等环节规范编码的衔接应用。 |
8月31日 | 国家市场监管总局、卫健委 | 《医疗器械不良事件检测和再评价管理方法》 | 明确了医疗器械上市许可持有人的主体责任;完善了不良事件检测制度,强化持有人直接报告不良事件的义务;强化了风险控制要求。 |
9月21日 | 卫健委、国家中医药管理局 | 关于开展“优质服务基层行”活动的通知 | 指出要重点发展基层医疗,提升乡镇卫生院及社区卫生服务中心的医疗服务水平。有望使乡镇卫生院和社区卫生服务中心的服务能力达到基本标准,部分服务能力较强的乡镇卫生院和社区卫生服务中心达到推荐标准。 |
10月23日 | 国家药监局 | 《国家药监局综合司关于贯彻实施〈医疗器械不良事件监测和再评价管理办法〉有关事项的通知》 | 各省级药监部门要督促医疗器械上市许可持有人切实履行不良事件监测责任,国家局监测评价机构要加快完善国家医疗器械不良事件监测信息系统 |
10月29日 | 卫健委 | 发布2018—2020年大型医用设备配置规划 | 全国规划配置大型医用设备22548台,新增10097台,分3年实施;大型医用设备要实行阶梯配置、资源共享。医疗设备需求增多给相关厂商带来利好。 |
11月8日 | 卫健委 | 全面提升县级医院综合能力工作方案(2018-2020年) | 到2020年,500家县医院和县中医医院分别达到“三级医院”和“三级中医医院”服务能力要求。进一步提升县级医院综合服务能力,力争实现90%的县医院、县中医院达到医疗服务能力基本标准要求。 |
11月28日 | 国家药监局 | 《关于印发医疗器械临床检查要点及判定原则的通知》 | 要求加强医疗器械临床试验过程的监督管理,并明确医疗器械临床试验前准备、受试者权益保障、临床试验方案、临床试验过程、记录与报告、试验用医疗器械管理等检查要点。 |
12月20日 | 卫健委、发改委等6部门 | 《关于开展建立健全现代医院管理制度试点的通知》 | 完善院内耗材准入遴选机制,明确高值耗材管理科室,完善高值耗材使用点评和异常使用预警机制。遴选确定了北京医院等148家医院试点建立健全现代医院管理制度。 |
数据来源:公开资料整理
随着全球人口增长,老龄化程度不断提高及发展中国家经济增长,全球医疗器械市场将持续增长。2016年全球医疗器械销售规模为3868亿美元,预计2022年有望超过5200亿美元。与此同时,随着我国经济发展,城镇化、人口老龄化的不断加深,医疗保险覆盖率的提高,医疗需求将不断释放,我国医疗器械行业发展迅速,行业规模从2007年434亿元增长至2016年3696亿元,复合增长率约24%。
2006-2016年中国医疗器械行业市场规模
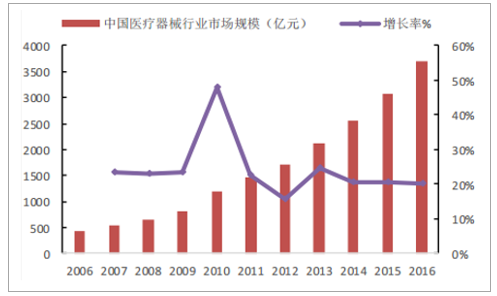
数据来源:公开资料整理
全球医疗器械行业市场规模(十亿美元)
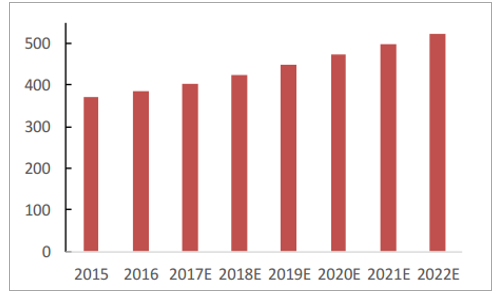
数据来源:公开资料整理
我国医疗器械产业组织结构分散。虽然我国医疗器械行市场规模不断扩大,但我国医疗器械企业规模过小,数量较多,产业竞争力水平处于较低位置,大量生产企业产品同质化严重。并且由于过去缺乏医疗器械GSP规范和统一招标,市场准入门槛低,医疗器械经销公司剧增,据统计,目前国内医疗器械商业公司已超过16万家。
两票制稳步推进,加速行业洗牌。2016年4月,国务院办公厅印发《关于深化医药卫生体制改革2016年重点工作任务的通知》,《通知》明确提出“两票制”概念,指出综合医改试点省份要在全省范围内推行“两票制”,积极鼓励公立医院综合改革试点城市推“两票制”。2016年7月,国家卫生计生委等9部委联合印发《2016年纠正医药购销和医疗服务中不正之风专项治理工作要点》,重申要在综合医改试点省和城市公立医院综合改革试点地区的药品、耗材采购中实行“两票制”。自此,耗材两票制与药品一样纳入重要议程。截至2018年7月份,已有18个省份或地区开始执行耗材两票制政策。
今年3月份,国家卫计委、财政部、人社部、发改委、中医药管理局、医改办联合发布了《关于巩固破除以药补医成果持续深化公立医院综合改革的通知》,通知明确提出高值耗材逐步实行两票制。耗材“两票制”逐步推进为器械行业整合带来巨大契机,将会加速淘汰大量中小型器械经销商,未建销售团队的小型器械公司也将会被波及,行业集中度有望提升。
各省份或地区耗材“两票制”执行情况
省份 | 发布日期 | 政策名称 |
河北 | 2016年6月 | 《河北省(部分地区)与三明市药品及医用耗材和检验试剂联合限价采购协议》 |
福建 | 2016年10月 | 《关于进一步打击骗取医疗保障基金和侵害患者权益行为的通知》 |
陕西 | 2017年1月 | 《关于深化药品耗材供应保障体系改革的通知》 |
海南 | 2017年1月 | 《海南省公立医疗机构药品、高值医用耗材采购“两票制”实施细则》 |
辽宁 | 2017年2月 | 《辽宁省医用耗材和检验检测试剂阳光采购实施方案》 |
黑龙江 | 2017年4月 | 《关于深入推进同级医疗机构检验结果互认实行检验检测试剂采购两票制的通知》 |
青海 | 2017年4月 | 《关于开展请还是2016年度公立医疗机构一般医用耗材挂网采购工作的通知》 |
天津 | 2017年5月 | 《天津市公立医疗机构药品和医用耗材采购推行“两票制”实施方案(征求意见稿)》 |
安徽 | 2017年11月 | 《安徽省公立医疗机构医用耗材采购“两票制”实施方案征求意见稿》 |
湖北 | 2017年12月 | 《关于建立高值耗材阳光采购省市联动管理机制实施方案的通知》 |
内蒙古 | 2018年3月 | 《2018年全区药政工作要点》 |
江西 | 2018年4月 | 《2018年全省药政工作要点》 |
西藏 | 2018年6月 | 《关于征求《西藏自治区公立医疗卫生机构医耗材和体外诊断试剂集中采购实施方案(试行)》意见的通知》 |
甘肃 | 2018年6月 | 《关于进一步巩固破除以药补医成果持续深化公立医院综合改革的实施意见》 |
湖南 | 2018年7月 | 《湖南省深化医药卫生体制改革2018年重点工作任务的通知》 |
广东 | 2018年7月 | 《关于巩固破除以药补医成果进一步深化公立医院综合改革的通知》 |
四川 | 2018年7月 | 《关于巩固破除以药补医成果持续深化公立医院综合改革的通知》 |
广西 | 2018年7月 | 《关于进一步巩固破除以药补医成果持续深化公立医院综合改革的通知》 |
数据来源:公开资料整理
控制耗占比政策对耗材价格形成长期压制。随着科学技术的飞速发展和医疗水平的不断提高,医用耗材在诊断、治疗、护理和康复等领域广泛应用,使用量迅速增长,医用耗材占比呈现逐年上升趋势。为控制医院成本,国务院办公厅2015年印发《关于城市公立医院综合改革试点的指导意见》,意见明确提出力争在2017年将药占比控制在30%以下,100元医疗收入中耗占比控制在20%以下。2017年4月,卫健委网站公布《关于全面推开公立医院综合改革工作的通知》,进一步明确提出“到2017年底,前4批试点城市公立医院药占比(不含中药饮片)总体下降到30%左右,百元医疗收入(不含药品收入)中消耗的卫生材料降到20元以下”,这是国家层面首次明确给出降低耗占比细化路线路。为了完成约束性任务,城市公立医院控制或减少医用耗材使用量,并通过集中采购、缩减供应商渠道等方式降低耗材采购价格。
前4批医改试点城市名单(共200市)
省份 | 试点城市 |
北京 | 北京市 |
上海 | 上海市 |
天津 | 天津市 |
重庆 | 重庆市 |
黑龙江省 | 七台河市、齐齐哈尔市、伊春市、双鸭山市、黑河市、大兴安岭地区 |
吉林省 | 长春市、延边州、通化市、松原市 |
辽宁省 | 鞍山市、本溪市、锦州市、盘锦市 |
内蒙古 | 鄂尔多斯市、呼和浩特市、乌海市、通辽市、包头市、兴安盟、乌兰察布市、锡林郭勒盟 |
宁夏 | 银川市、吴忠市、中卫市、固原市、石嘴山市 |
广西 | 柳州市、玉林市、桂林市、防城港市、百色市 |
新疆 | 克拉玛依市、吐鲁番、哈密地区 |
西藏 | 拉萨市 |
山东省 | 潍坊市、东营市、威海市、青岛市、济南市、滨州市 |
山西省 | 太原市、运城市、晋中市、长治市、阳泉市 |
河北省 | 唐山市、邯郸市、张家口市、邢台市、沧州市、衡水市 |
河南省 | 洛阳市、焦作市、濮阳市、漯河市、三门峡市、鹤壁市 |
陕西省 | 宝鸡市、延安市、西安市、安康市、咸阳市、铜川市、商洛市、渭南市、榆林市、汉中市 |
青海省 | 西宁市、海东市、海西州、海南州、海北州、黄南州、果洛州、玉树州 |
甘肃省 | 庆阳市、白银市、酒泉市 |
湖北省 | 鄂州市、武汉市、襄阳市 |
湖南省 | 14个地级市州已全覆盖 |
四川省 | 21个地级市州已全覆盖 |
贵州省 | 遵义市、贵阳市、安顺市、铜仁市、黔南州、黔东南州、六盘水市 |
云南省 | 昆明市、玉溪市、红河州、普洱市、曲靖市、大理州 |
江西省 | 新余市、鹰潭市、九江市、上饶市、萍乡市、景德镇市、宜春市 |
安徽省 | 16个地级市已全覆盖 |
浙江省 | 11个地级市已全覆盖 |
江苏省 | 13个地级市中还有宿迁市未纳入 |
福建省 | 9个地级市已全覆盖 |
广东省 | 深圳市、珠海市、东莞市、中山市、惠州市、江门市、肇庆市 |
海南省 | 三亚市、儋州市、海口市 |
数据来源:公开资料整理
全面实施耗材零加成政策提上日程,现有价格系统将受到冲击。2017年11月,国家发改委发布《关于全面深化价格机制改革的意见》,意见提出要“巩固取消药品加成成果,进一步取消医用耗材加成”。此前,已有部分省市开展耗材零加成试点,该意见将进一步推动全国范围内公立医疗机构实施耗材零加成进程,高值耗材产品价格透明化是必然趋势,其现有的价格系统将会受到严重冲击。
已实施耗材零加成的省份及城市
省份或城市 | 推行日期 | 相关政策或决议 |
湖北 | 2018年2月 | 在湖北省物价工作会议上,继取消药品加成后,湖北今年将全面取消公立医院医用耗材加成 |
贵州 | 2018年2月 | 《贵州省关于做好公立医院综合改革医疗服务价格动态调整工作的通知》 |
山东平邑县 | 2018年1月 | 《关于公布临沂市公立医疗机构医疗服务价格(2017版)的通知》 |
宁夏 | 2018年1月 | 《2018年宁夏价格工作要点》 |
广东 | 2018年3月 | 广东省卫计委主任段宇飞明确2018年广东省将积极落实、推动耗材取消加成 |
福建厦门市 | 2015年6月 | 《厦门市深化医药卫生体制改革实施方案》 |
北京 | 2017年12月 | 《北京医改:向健康迈进——《北京市“十三五”期间深化医药卫生体制改革实施方案》解读问答》 |
天津 | 2017年2月 | 《市卫生计生委关于转发天津市深化医药卫生体制综合改革方案的通知》 |
安徽 | 2016年10月 | 《安徽省人民政府办公厅关于印发安徽省2016年深化医药卫生体制综合改革试点重点工作任务的通知》 |
湖南 | 2016年10月 | 《城市公立医院医药价格改革指导意见》 |
辽宁 | 2018年5月 | 《辽宁省公立医院取消医用耗材加成调整医疗服务价格指导意见》 |
四川 | 2018年7月 | 《关于四川省公立医疗机构取消医用耗材加成的通知》 |
数据来源:公开资料整理
分级诊疗制度不断完善,基层医疗机构医疗设备配置需求有望提升。当下,我国80%医疗卫生资源集中在城市,其中80%集中在大中型医院;而医疗卫生服务的需求大部分在基层,医疗资源错配形势严峻。为解决基层看病难问题,医改十三五规划将建立“分级诊疗制度”置于五项重点医改任务之首,分级诊疗成为医改的重中之重。近年来,不少地方开展了一系列促进分级诊疗的改革探索,中央政府也提出了推进分级诊疗、建立家庭医生制度的相关政策。随着分级诊疗政策的不断推进,基层医疗就诊需求有望提升,而目前我国基层医疗机构的医疗设备配置水平普遍偏低,配置缺口将不断增大,但由于基层医疗机构收入规模有限,性价比相对较高的国产医疗器械成为配送首选。
分级诊疗相关政策
政策 | 政策发布机构 | 推出时间 |
国家卫生计生委关于推进医疗机构远程医疗服务的意见 | 卫计委 | 2014.8 |
关于推进和规范医师多点执业的若干意见 | 卫计委 | 2015.1 |
全国医疗卫生服务体系规划纲要(2015—2020年) | 国务院 | 2015.3 |
国务院办公厅关于全面推开县级公立医院综合改革的实施意见 | 国务院 | 2015.4 |
国务院办公厅关于城市公立医院综合改革试点的指导意见 | 国务院 | 2015.5 |
国务院办公厅关于推进分级诊疗制度建设的指导意见 | 国务院 | 2015.9 |
县医院医疗服务能力推荐标准 | 卫计委 | 2016.4 |
十三五”深化医药卫生体制改革规划 | 国务院 | 2016.12 |
国务院办公厅关于印发深化医药卫生体制改革2017年重点工作任务的通知 | 国务院 | 2017.4 |
数据来源:公开资料整理
政府出台多项政策支持国产器械设备发展。目前,我国主要中高端医疗设备市场依然被外资品牌垄断,国产医疗器械普遍存在销售难、入院难的问题。为打破外资品牌垄断现在,降低医院采购成本,2016年以来,政府先后出台多项政策鼓励公立医院优先配置国产医用设备,国产医疗器械的进口替代步伐有望进一步加快。
国家出台支持国产器械相关政策
推行时间 | 政策/文件名 | 核心内容 |
2016.07 | 《关于进一步深化公立医院综合改革的指导意见》 | 公立医院优先配备国产医用设备,在保障医疗质量的前提下,优先采购和使用国产医用耗材 |
2016-2017 | 多省发布采购目录或通知 | 明确提出若国产医疗器械能够满足要求的,公立医院或政府采购原则上须采购国产产品 |
2018.04 | 《关于促进首台(套)重大技术装备示范应用的意见》 | 发挥保险功能,为用户降低使用国产首台设备的风险 |
2018.08 | 《深化医药卫生体制改革2018年下半年重点工作任务的通知》 | 推进医疗器械国产化,促进创新产品应用推广 |
2018.11 | 《关于政协十二届全国委员会第五次会议第0692号(医疗体育类079号)提案答复的函》 | 提出积极支持国产医疗器械采购,组织遴选出符合临床需要、产品质量优良、具有市场竞争力和发展潜力的优秀国产医疗设备目录,引导医疗机构更多使用国产设备 |
2018.11 | 《2018-2020年全国大型医用设备配置规划》 | 明确到2020年底,全国规划配置大型医用设备22548台,其中新增10097台,分3年实施。大型医疗设备配置要实施阶梯配置,严格控制公立医院超常装备 |
数据来源:公开资料整理
医疗器械创新迎来黄金时期。近年来,我国鼓励医疗器械创新政策不断出台,对刺激产业创新起到巨大推动作用。据统计,2017年,国家食品药品监管机构依职责受理医疗器械注册、延续注册和许可事项变更申请6834项;完成注册申请技术审评8579项;批准医疗器械注册、延续注册和许可事项变更注册8923项;介入人工生物心脏瓣膜等12个创新产品通过特别审批通道加速上市,在政策推动下,我国创新医疗器械将迎来加速发展。
相关报告:智研咨询发布的《2019-2025年中国医疗器械行业市场专项调研及投资前景分析报告》
 智研咨询 - 精品报告
智研咨询 - 精品报告

2024-2030年中国骨科医疗器械行业市场行情监测及前景战略研判报告
《2024-2030年中国骨科医疗器械行业市场行情监测及前景战略研判报告》共十一章,包含全球骨科医疗器械领先企业经营分析,中国骨科医疗器械领先企业经营分析,中国骨科医疗器械行业投资前景分析等内容。
文章转载、引用说明:
智研咨询推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源(智研咨询)。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
智研咨询倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。



![趋势研判!2024年中国口腔医疗器械行业市场规模、竞争格局及发展现状分析:市场需求驱动规模增长,国产替代趋势进一步加强[图]](http://img.chyxx.com/images/2022/0330/b388a599ab8b82a70e79838a8b0d600efa11727f.png?x-oss-process=style/w320)



