2017年优先审评发力,一批创新药加速审批上市。2016 年 2 月 26 日,CFDA 发布《关于解决药品注册申请积压实行优先审评审批的意见》,正式确定了三类可优先审评审批药品的范围:创新药、儿童用药、临床亟需药、专利过期药和首仿药等受到重点扶持。截至2017年底,药审中心共将25批 423 件注册申请纳入优先审评程序,其中具有明显临床价值的新药占比最大,共191件,占45%,有33件具有明显临床价值的新药注册申请通过优先审评程序得以加快批准上市。
优先审评新药占比45%
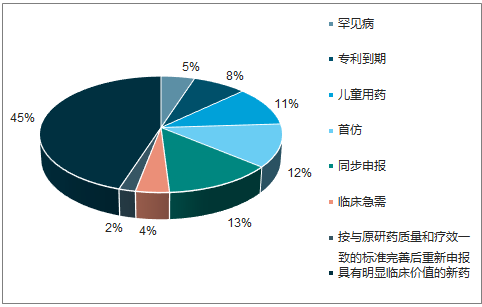
数据来源:公开资料整理
相关报告:智研咨询发布的《2018-2024年中国中药创新药物行业竞争态势及未来发展趋势报告》
2017年全球52个创新药首次上市,是继2016的“33个”低谷后的强势反弹。2017 年全球获批上市113个新药,其中 52个新药首次上市,7款为首创新药(first-in-class),包括 CAR-T 疗法,色氨酸羟化酶 1(TPH1)抑制剂telotristatethyl,抗白介素-4 受体α(IL-4Rα)单克隆抗体((MAb) dupilumab 和嘌呤核苷酸磷酸化酶(PNP)抑制剂 forodesine。具体细分来看,2017全球获批的生物药和新分子实体持平,新药上市申请中新分子实体占比仍超过一半。2017 全球获批的生物药和新分子实体相较 2016 年均有较大幅度的提升,两者数量相等,同时新药上市申请新分子化学实体占66%,仍然超过创新生物药。
2017全球获批创新生物药和新分子实体持平
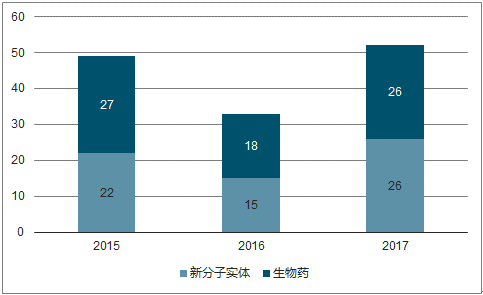
数据来源:公开资料整理
全球新药上市申请中新分子实体占比66%
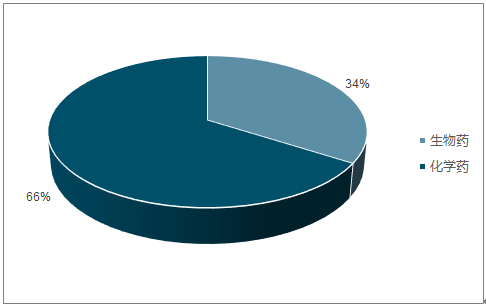
数据来源:公开资料整理
作为全球药物创新的领头羊,2017年美国 46个新药获批上市。2017年FDA药品审评与研究中心(CDER)批准了46个新药,达到近10 年新药批准的最高值,这些新药包括新药申请NDA中的新分子实体(NME)34个和生物制品许可申请(BLA)12个。
2017年美国46个新药获批上市,达近10年最高

数据来源:公开资料整理
2017我国1类创新药申报数量174个,超60个临床Ⅲ期1类药物即将迎来收获期。 2017 年我国1.1类化药申报数目为112 个,达十年之最;1 类生物药申报数量62个,是 2016 年的2倍多。根据数据,截至2018年5月有超 60个1类新药进入临床Ⅲ期。
2017年我国新分子实体申报112项
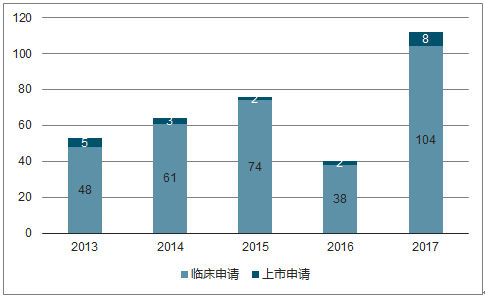
数据来源:公开资料整理
2017年我国1类生物药申报62项
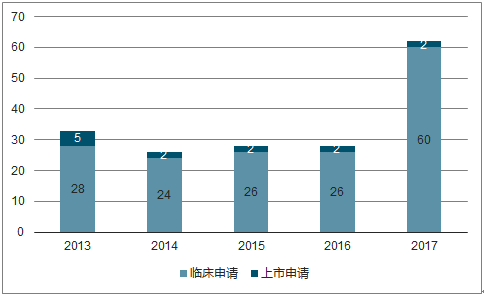
数据来源:公开资料整理
 智研咨询 - 精品报告
智研咨询 - 精品报告

2024-2030年中国创新药行业运营现状及市场规模预测报告
《2024-2030年中国创新药行业运营现状及市场规模预测报告》共十一章,包含中国创新药产业国际竞争力分析,2024-2030年中国创新药行业发展趋势展望分析,2024-2030年中国创新药行业投资风险分析及建议等内容。
文章转载、引用说明:
智研咨询推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源(智研咨询)。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
智研咨询倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。








