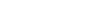目前国内临床肿瘤用药还是以传统化疗药物和中药提取物为主要临床用药, 单抗和替尼等小分子靶向药物应用比例较低,未来随着国内靶向药物数量的增加,用药成本的下降,医保覆盖率的提升,国内肿瘤临床用药格局将有重大变化。
(一) 国内目前肿瘤用药格局情况
从临床用药格局来看,肿瘤领域不但是大病种疾病,也是未来用药格局变化最大的大病种领域。 2016 年国内临床肿瘤的药物治疗中,传统化疗药物(包括抗代谢类、铂化合物、烷化剂和激素等等)和植物药占据了绝大部分的市场份额(金额),单抗和小分子靶向药仅占约 20%。而且由于靶向药物价格通常较贵,所以如果转换为用量的话,占比将更低。
2016 年样本医院肿瘤用药金额格局
数据来源:公开资料整理
(二) 国内肿瘤用药市场现状与趋势
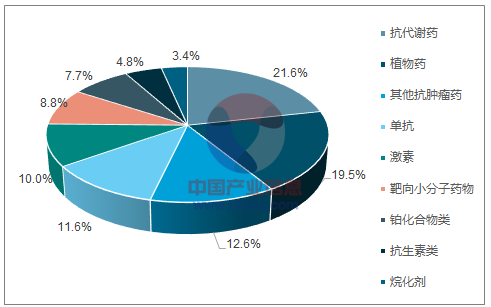
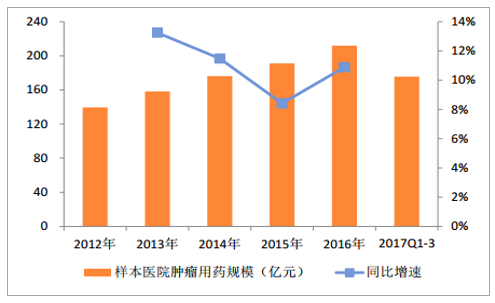
2016 年样本医院肿瘤用药规模约为 212 亿元(按照平均 5-6 倍放大,终端市场规模大约 1200亿元),同比增长 13.24%。年均增速大约在 10-13%之间。其中靶向药物(单抗+替尼), 2016 年样本医院规模约为 44 亿元,同比增长 10.7%。靶向药物在肿瘤用药中的整体占比稳步提升, 2016 年占比约为 20.5%; 2017 年前三季度这一比例上升为 22.1%左右。
样本医院肿瘤用药规模和增速
数据来源:公开资料整理
样本医院肿瘤靶向药规模、增速和占比变化
数据来源:公开资料整理
因为我们统计的是用药金额的数据, 2016 年人社部出台了第一批谈判目录三个品种,其中包括大病种肿瘤主流用药吉非替尼和埃克替尼,在当年肿瘤小分子靶向药格局中,吉非替尼占比 15.92%,埃克替尼占比 13.01%,二者合计占比接近 30%,谈判目录降价幅度在 55%左右。 2017 年 7 月份第二批 36 个谈判目录出台,包含了 8 个肿瘤靶向药(4 个单抗 4 个替尼),降幅基本上在 40-50%以上,所以我们估计从金额来看,大幅降价因素会对 2017-2018 年国内肿瘤用药金额格局情况产生影响。
样本医院肿瘤小分子靶向药规模和增速
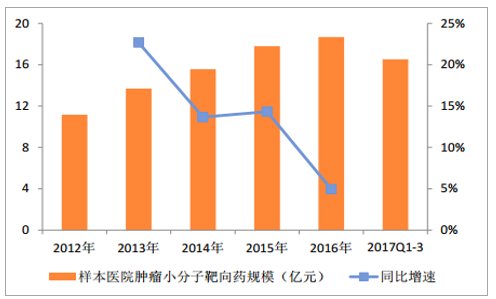
数据来源:公开资料整理
样本医院肿瘤单抗规模和增速
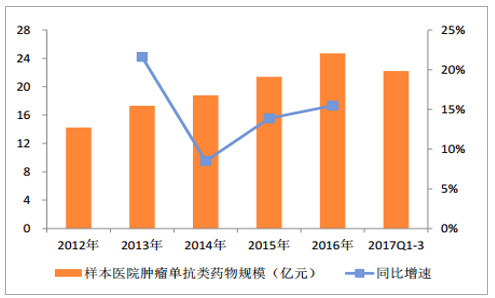
数据来源:公开资料整理
在药政鼓励创新药的背景下, 2017 年一年 CFDA 新批了 6 个小分子靶向药,所以药物种类的增加以及品种的快速放量,将推动靶向药物在肿瘤整体用药中的占比持续上升。
(三) 国内未来肿瘤用药格局料发生巨大变化
我们认为未来国内肿瘤临床用药格局将发生重大的变化, 这种变化的诱发因素主要包括几点:第一,靶向药物种类的丰富。 第二,用药成本的下降。
1、 靶向药物种类的丰富
靶向药物在国内临床应用的时间不是很长, 2005 年国内引进了第一个小分子靶向药物伊马替尼用于白血病的治疗,此后至今,包括吉非替尼、索拉菲尼、厄洛替尼和舒尼替尼等共计 13 个品种取得 CFDA 药品注册证书,其中 2011年上市的埃克替尼和 2013 年上市的阿帕替尼是国产一类新药,其余均为进口药品。 大分子靶向药数量较少, 目前国内肿瘤领域的单抗有六种。
国内上市的靶向药
序号 | 国内上市时间 | 药品名 | 商品名 | 生产企业 | 主治肿瘤病种 |
小分子靶向药 | |||||
1 | 2002 年 | 伊马替尼 | 格列卫 | 诺华 | 白血病 |
2 | 2005 年 | 吉非替尼 | 易瑞沙 | 阿斯利康 | NSCLC |
3 | 2006 年 | 索拉非尼 | 多吉美 | 拜耳 | 肾癌 |
4 | 2007 年 | 厄洛替尼 | 特罗凯 | 罗氏 | NSCLC |
5 | 2007 年 | 舒尼替尼 | 索坦 | 辉瑞 | 晚期肾癌 |
6 | 2009 年 | 尼洛替尼 | 达希纳 | 诺华 | 白血病 |
7 | 2011 年 | 埃克替尼 | 凯美纳 | 贝达 | NSCLC |
8 | 2011 年 | 达沙替尼 | 施达赛 | 百时美施贵宝 | 白血病 |
9 | 2013 年 | 拉帕替尼 | 泰立莎 | 葛兰素史克 | 乳腺癌 |
10 | 2014 年 | 阿帕替尼 | 艾坦 | 恒瑞 | 晚期胃癌 |
11 | 2014 年 | 克唑替尼 | 赛可瑞 | 辉瑞 | NSCLC |
12 | 2015 年 | 阿昔替尼 | 英立达 | 辉瑞 | 肾癌 |
13 | 2017 年 | 奥希替尼 | 泰瑞沙 | 阿斯利康 | NSCLC |
14 | 2017 年 | 芦可替尼 | 捷恪卫 | 诺华 | 骨髓纤维化 |
15 | 2017 年 | 阿法替尼 | 吉泰瑞 | 勃林格殷格翰 | NSCLC |
16 | 2017 年 | 伊布替尼 | 亿珂 | 杨森 | 白血病 |
17 | 2017 年 | 瑞戈非尼 | 拜万戈 | 拜耳 | 结直肠癌 |
18 | 2017 年 | 维莫非尼 | 佐博伏 | 罗氏 | 黑色素瘤 |
大分子靶向药 | |||||
1 | 2000 年 | 利妥昔单抗 | 美罗华 | 罗氏 | 淋巴瘤 |
1 | 2002 年 | 曲妥珠单抗 | 赫赛汀 | 罗氏 | 乳腺癌 |
2 | 2006 年 | 西妥昔单抗 | 爱必妥 | 默克 | 转移结直肠癌 |
3 | 2007 年 | 碘[131I]美妥昔单抗 | 利卡汀 | 成都华神生物 | 肝癌 |
4 | 2009 年 | 尼妥珠单抗 | 泰欣生 | 百泰生物 | 鼻咽癌 |
6 | 2015 年 | 贝伐珠单抗 | 安维汀 | 罗氏 | 结直肠癌 |
数据来源:公开资料整理
我们认为随着国内药政审批制度的变化, 新药在国内上市审批的进程将加快。 2015 年 CFDA 发布的《关于改革药品医疗器械审评审批制度的意见》(44 号文),开始了一致性评价、优先审评审批和 MAH 等制度制。 2017 年 6 月中国加入了 ICH,制度环境有利于缩短创新药的上市时间。 2017 年国内新批了 6 个小分子靶向药,其中 4 个通过优先审评的品种, 2017 年 3 月份,阿斯利康的新一代 TKI 类抑制剂奥希替尼(40mg, 80mg)获得 CFDA 上市许可,该药物 2016 年 11 月的临床申请进入优先审评名单, 2017 年 3 月上市申请进入优先审评,当月即获得上市许可。
近年关于创新药相关政策
时间 | 政策 | 发布部门 | 主要内容 |
2015.8.18 | 关于改革药品医疗器械审评审批制度的意见国发〔2015〕 44 号 | 国务院 | 对审评审批制度提出改革意见,这也是后续开展仿制药一致性评价、临床试验资料自查核查、优先审评审批品种评定以及 MAH 试点方案等具体工作的指导原则 |
2015.11.6 | 关于征求药品上市许可持有人制度试点方案和化学药品注册分类改革工作方案两个征求意见稿意见的公告(2015 年第 220 号) | CFDA | MAH 试点方案已开始落地 |
2015.11.13 | 关于征求《关于解决药品注册申请积压实行优先审评审批的意见(征求意见稿)》意见的公告(2015 年第 227 号) | CFDA | 对优先审评审批的范围、程式、工作要求作出明确规定,并征集相关意见。 |
2016.3.4 | 关于发布化学药品注册分类改革工作方案的公告(2016 年第 51 号) | CFDA | 公布化学药品新注册分类,有利于鼓励新药创新,促进产业升级 |
2016.3.5 | 关于首批优先审评专利到期品种和申请人的公示 | CDE | 第一批优先审评品种公布 |
2016.6.6 | 关于印发药品上市许可持有人制度试点方案的通知 国办发〔2016〕 41 号 | 国务院 | 在北京、天津、河北、上海等 10 个省(市)开展 MAH试点 |
2017.2.16 | 关于发布医疗器械优先审批申报资料编写指南(试行)的通告(2017 年第 28 号) | CFDA | 明确优先审评审批范围、程序及其他具体要求,帮助企业进一步做好医疗器械优先审批申报资料编写工作 |
2017.5.11 | 关于鼓励药品医疗器械创新加快新药医疗器械上市审评审批的相关政策(征求意见稿) | CFDA | 完善评审制度,建立基于专利强制许可的优先审评审批制度,支持创新药临床使用等。 |
2017.10.8 | 关于深化审评审批制度改革鼓励药品医疗器械创新的意见 | 国务院 | 全面实施 MAH 制度,优化审评审批流程,建立专利链制度等 |
2017.10.10 | 关于调整进口药品注册管理有关事项的决定 | CFDA | 鼓励境外未上市新药经批准后在境内外同步开展临床试验,缩短境内外上市时间间隔,满足公众对新药的临床需求 |
2017.10.27 | 药物临床试验机构管理规定(征求意见稿) | CFDA | 实施备案制、提高伦理审查效率、优化临床试验审查程序、接受境外临床试验等 |
数据来源:公开资料整理
相关报告:智研咨询发布的《2018-2024年中国抗肿瘤用药市场深度调研及投资前景分析报告》

 公众号
公众号
 小程序
小程序
 微信咨询
微信咨询

















![研判2025!中国皮肤学级护肤品行业市场政策、产业链图谱、发展现状及发展趋势分析:18-35岁的年轻女性为核心消费人群[图]](http://img.chyxx.com/images/2022/0408/54b870b64f647f1fc10474b02796382c9242dcfa.png?x-oss-process=style/w320)
![研判2025!中国工业铝型材行业政策汇总、产业链图谱、生产现状、竞争格局及发展趋势分析:光伏型材占工业铝型材总产量的33.7%[图]](http://img.chyxx.com/images/2022/0330/b388a599ab8b82a70e79838a8b0d600efa11727f.png?x-oss-process=style/w320)
![趋势研判!2025年中国无人驾驶物流车行业全景速览:在政策与技术的共同驱动下,无人物流车的发展势不可挡,行业有望迎来爆发式增长[图]](http://img.chyxx.com/images/2022/0408/1ba88a0bac4b4a65439b806124f6fc0f4ab03cad.png?x-oss-process=style/w320)
![趋势研判!2025年中国聚氨酯密封胶行业市场现状及发展趋势分析:在多个领域渗透率的持续提升,应用前景广阔[图]](http://img.chyxx.com/images/2022/0330/ff5315f651f3e124d0f5a156ac51655e46e5433f.png?x-oss-process=style/w320)
![研判2025!中国锂电池注液机行业分类概述、市场现状、代表性企业分析及未来前景展望:市场规模扩大与技术革新双轮驱动,助力产业高质量发展[图]](http://img.chyxx.com/images/2022/0330/99d4e8a78387e45474dcca8da0b56041c69dec09.png?x-oss-process=style/w320)
![研判2025!中国金属-氧化物半导体场效应晶体管(MOSFET)行业概述、产业链、市场规模及发展趋势分析:国产厂商崛起打破进口依赖 [图]](http://img.chyxx.com/images/2022/0408/55d853aceb464ffcf6fad7c27bbd7795797b1b5a.png?x-oss-process=style/w320)