一、1 1-10月累计批签发量同比小幅下滑2%,环比降幅缩窄,免疫规划疫苗份额提升
行业概况:2019年1-10月,疫苗行业整体批签发量为44630万支,同比下滑2%,下滑幅度较1-9月明显缩窄,主要受长生生物疫苗事件及疫苗法出台监管趋严导致批签发速度下降影响,现阶段批签发速度已有提升。 2011-2018年,行业整体批签发量由79402.9万支下降到54076.3万支,CAGR为-4.7%;
品类结构:行业整体批签发量前三大类分别是肝炎、 脑膜炎及百白破系列,合计市场份额为44%。 1-10月:肝炎类疫苗批签发量同比下滑16%,市场份额小幅下降至16%。 脑膜炎类疫苗批签发量同比下滑6%,市场份额下降至12%。 百白破系列疫苗批签发量同比增长15%,市场份额稳定在15%;
疫苗类型:国家免疫规划品种市场份额由2011年的30%提高到2019年10月底的50%,非国家免疫规划品种市场份额由2011年的70%降低到2019年10月底的50%。 短期来看,随着非国家免疫规划的重磅产品获批上市,有望扩大非国家免疫规划品种整体市场份额。 长期来看,随着行业的发展及国家卫生战略的调整,未来国家免疫规划品种有可能再度扩容;
疫苗行业全品种2011年以来批签发量统计
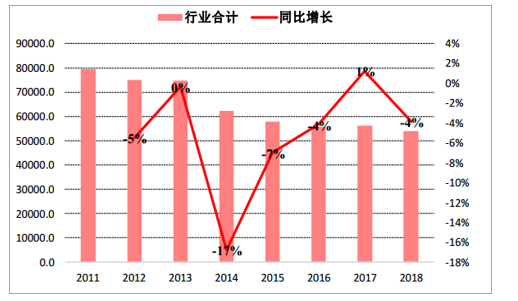
数据来源:公开资料整理
疫苗行业全品种近年1-10月累计批签发量
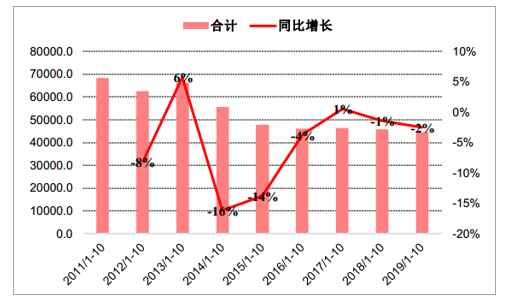
数据来源:公开资料整理
近年疫苗品种竞争格局
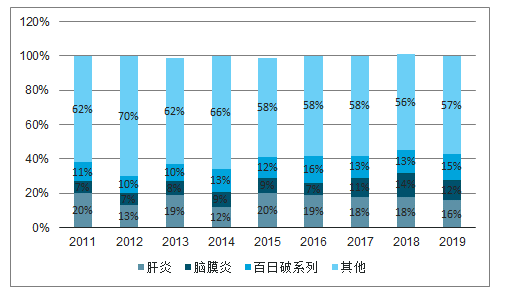
数据来源:公开资料整理
近年疫苗种类市场格局
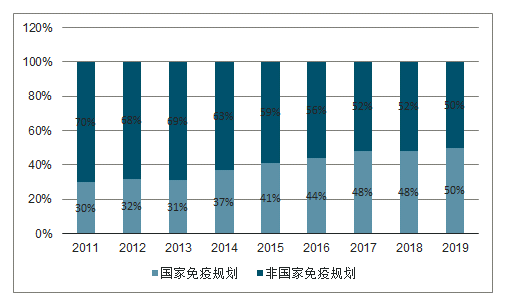
数据来源:公开资料整理
品种大类增速梳理
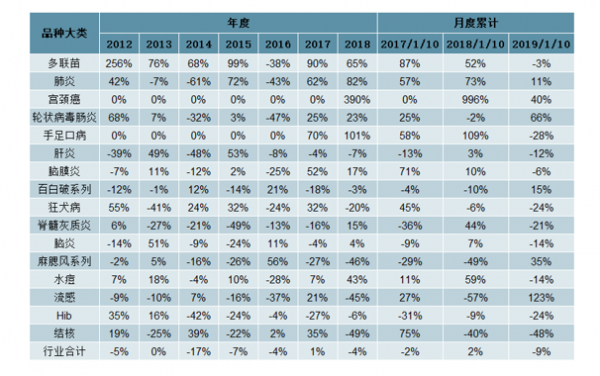
数据来源:公开资料整理
二、疫苗行业迎来发展新篇章
历经最高立法机关三次审议,《疫苗管理法》在 2019 年 6 月 29 日获得十三届全国人大常委会第十一次会议表决通过,并将于 2019 年 12 月 1 日起施行。
这是我国首部有关疫苗管理的专门法律,共十一章一百条,分别对疫苗研制和注册、疫苗生产和批签发、疫苗流通、预防接种、异常反应监测和处理、疫苗上市后管理、保障措施、监督管理、法律责任等作出了明确规定,体现了严控质量、措施全面、社会共治等特点,而管得严、罚得重更是彰显了我国加强疫苗监管的决心。
指明行业发展方向
《疫苗管理法》向整个疫苗行业传递了多方面的信息,为疫苗行业的发展指明了方向。一是严格准入管理。《疫苗管理法》指出,国家对疫苗生产实行严格的准入制度,从事疫苗生产活动,应当经省级以上人民政府药品监督管理部门批准,取得药品生产许可证;疫苗上市许可持有人的法定代表人、主要负责人应当具有良好的信用记录,生产管理负责人等关键岗位人员应当具有相关专业背景和从业经历。
二是社会共治。《疫苗管理法》规定了各级政府和各有关部门在疫苗的生产、流通、使用各环节中的责任;规定了新闻媒体的舆论监督责任和科学公正的报道原则;规定了疫苗产品上市许可持有人的信用公示和联合惩戒制度;规定了疫苗生产企业的产品责任保险和异常反应补偿制度;规定了监管信息和企业信息公开制度,接受社会监督等,体现了各方共同加强疫苗行业社会治理的思路。
三是严惩违法行为。对于违反《疫苗管理法》规定,构成犯罪的,《疫苗管理法》明确规定要“依法从重追究刑事责任”。《疫苗管理法》第八十条规定,生产、销售的疫苗属于假药的,处疫苗货值金额十五倍以上五十倍以下的罚款;生产、销售的疫苗属于劣药的,处疫苗货值金额十倍以上三十倍以下的罚款;货值金额不足五十万元的,均按五十万元计算;生产、销售的疫苗属于假药,或者生产、销售的疫苗属于劣药且情节严重的,法定代表人、主要负责人等,除处所获收入一倍以上十倍以下的罚款,终身禁止从事药品生产经营活动外,还交由公安机关处五日以上十五日以下拘留。
四是全程监管。《疫苗管理法》从疫苗的研制、生产、流通、接种等各环节都提出了要加强监管。其中,对设备变更、工艺变更、产品质量回顾等规定了详细的管理制度,实现疫苗全程电子追溯制度,疫苗上市许可持有人应当建立疫苗电子追溯系统,与全国疫苗电子追溯协同平台相衔接,实现生产、流通和预防接种全过程最小包装单位疫苗可追溯、可核查。
各方应严格执行法律条款
《疫苗管理法》大大强化了国家对疫苗行业的管理,势必对整个疫苗行业造成较大影响,对行业的规范发展起到很好的助推作用。但从行业发展角度看,以下几个方面也不容忽视。
一是提高科研创新能力。《疫苗管理法》指出,国家支持疫苗基础研究和应用研究,促进疫苗研制和创新。我国是疫苗需求大国,疫苗在保障国人健康方面发挥着重要作用。从行业发展来看,疫苗行业始终是朝阳产业,值得相关企业大力投入。随着我国医改的深入进行,企业的竞争终归要落实到创新能力上。在此背景下,疫苗上市许可持有人之间进行高水平的竞争,需要全力提升生产研发实力,寻求创新发展之路。
二是从严落实立法要求。疫苗上市许可持有人要从上至下把好质量关,认真落实疫苗管理的相关规定。对疫苗质量和影响最大的当属生产环节,在日常的生产工作中,要全面贯彻实施相应的质量管理体系要求,做好质量管理工作。生产人员无疑是保证疫苗质量的最核心因素之一,对此,《疫苗管理法》在生产人员方面做了着重规定。如第二十三条规定了关键岗位人员备案审查制度,要求疫苗上市许可持有人的法定代表人、主要负责人应当具有良好的信用记录,生产管理负责人、质量管理负责人等关键岗位人员应当具有专业背景和相关从业经历。所以,疫苗上市许可持有人应当始终牢记人是管理环节中最重要的影响因素,严格执行关键岗位人员的准入条件,夯实疫苗安全的基础。
三是切实加强全生命周期管理。疫苗上市许可持有人要严格按照行业标准实施企业的日常生产工作,勿让类似长春长生疫苗事件再次发生。从生产到流通到贮存再到接种使用,每一个环节都要严格把关,不能出现任何差错,相关企业负责人与质量负责人要承担起相应的责任。
四是注重新科技成果的运用。《疫苗管理法》规定了对疫苗上市许可持有人的产品电子监管、产品质量监测和质量回顾分析等一系列责任,做好这些工作,离不开大数据、人工智能等新科技,所以,疫苗上市许可持有人要紧跟时代步伐,加强科技创新成果的运用,实现全程管理的信息化和智能化。保障疫苗安全,后退没有出路,唯有和前沿科技结合才是解决之道。
五是加强行业组织建设。《疫苗管理法》既规定了政府和相关监管部门的管理责任,又强调了疫苗上市许可持有人对疫苗质量的首要责任。疫苗不安全,既要追究生产者的责任,也要追究监管者的责任。二者在法律框架内各自履行责任,但不应将二者的关系对立起来。在这个关系中,行业组织应当发挥更大的作用。普及疫苗知识,化解潜在社会风险,应当成为行业组织的重要工作内容;同时,行业组织也要成为监管部门和企业之间交流的纽带,起到上情下达、下情上传的作用。
总体而言,《疫苗管理法》的出台势必会推动整个疫苗行业的发展,对于未来,我们应抱着乐观谨慎的态度。乐观在于疫苗行业将迎来规范健康发展;谨慎则在于在行业规范的过程中,不可避免会遇到一些波折,而这些波折,需要行业参与者们慎重对待。
相关报告:智研咨询发布的《2020-2026年中国动物疫苗行业投资潜力分析及投资机遇分析报告》
 智研咨询 - 精品报告
智研咨询 - 精品报告

2024-2030年中国流行性感冒疫苗行业发展动态及投资规划分析报告
《2024-2030年中国流行性感冒疫苗行业发展动态及投资规划分析报告》共十四章。首先介绍了无人接驳车行业市场发展》共十四章,包含2024-2030年流行性感冒疫苗行业投资机会与风险,流行性感冒疫苗行业投资战略研究,研究结论及投资建议等内容。
文章转载、引用说明:
智研咨询推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源(智研咨询)。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
智研咨询倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。







![2023年中国流行性感冒疫苗行业发展现状:产业发展前景广阔,疫苗覆盖率有待进一步提升[图]](http://img.chyxx.com/images/2022/0330/ff5315f651f3e124d0f5a156ac51655e46e5433f.png?x-oss-process=style/w320)
