18年,药监局、财政部、海关总署等多部委继续落实42号文对创新药的鼓励。其中:药监局出台了系列加强药审部门与企业的沟通、加强知识产权保护的文件,创新药企研发效率提升、知识产权获得更好保护;同时,合理优化临床审批、加速创新药临床进展;加速罕见病审批,先后明确了罕见病用药数据保护期、第一批罕见病目录、加速境外罕见病用药在我国上市等配套政策及文件;药监局、财政部、海关总署等多部委降低增值税率及进口关税、医保准入谈判等角度加快落实了创新药的配套支付文件;加快接受境外数据及境外药品在我国上市,倒逼国内企业进行国际化竞争。
2018年创新药相关政策回顾
发布机构 | 发布时间 | 文件 | 主要内容 |
药监局 | 3月11日 | 药品研发与技术审评沟通交流管理办法(修改稿) | ①适用于创新药物、改良型新药、生物类似药、复杂仿制药以及一致性评价品种等研发过程和注册申请中的沟通交流;②就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流;③规定的沟通交流会议适用于创新药物、改良型新药、生物类似药、复杂仿制药以及一致性评价品种等研发过程和注册申请中的沟通交流;④沟通交流的形式包括:面对面会议、视频会议、电话会议或书面回复。 |
药监局 | 4月26日 | 药品试验数据保护实施办法(暂行) | 对在中国境内获批上市的创新药给予6年数据保护期,创新治疗用生物制品给予12年数据保护期。对罕见病用药或儿童专用药,自该适应症首次在中国获批之日起给予6年数据保护期。 |
财政部、海关总署、税务总局、药监局 | 4月27日 | 关于抗癌药品增值税政策的通知 | ①生产销售和批发、零售抗癌药品,可选择依照3%征收率计算缴纳增值税;②对进口抗癌药品,减按3%征收进口环节增值税;③公布第一批降税抗癌药品清单。 |
药监局 | 5月17日 | 关于加强药品审评审批信息保密管理的实施细则 | 维护药品注册申请人的合法权益,规范和加强审评审批信息保密管理,明确将13种情形视为泄露保密信息。 |
卫健委、科技部、工信部、药监局、中医药管理局 | 5月22日 | 第一批罕见病目录 | 第一批纳入目录的罕见病共121种,加强我国罕见病管理,提高罕见病诊疗水平。 |
卫健委、药监局 | 5月23日 | 优化药品注册审评审批有关事宜的公告 | 对防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品加快审评审批。①建立与申请人之间的沟通交流机制,加强对药品研发的指导,对纳入优先审评审批范围的注册申请,审评、检查、审批等各环节优先配置资源,加快审评审批。②进口药品注册申请人经研究认为不存在人种差异的,可以提交境外取得的临床试验数据直接申报药品上市注册申请。③基于产品安全性风险控制需要开展药品检验工作,药审中心经评估认为无需检验的,不再通知开展检验工作;④取消进口药品再注册核档程序。 |
药监局 | 7月10日 | 关于发布接受药品境外临床试验数据的技术指导原则的通告 | ①境内申报注册时,接受境外临床试验数据作为临床评价资料的工作;②所涉及的境外临床试验数据,包括但不限于申请人通过创新药的境内外同步研发在境外获得的临床试验数据;③在境外开展仿制药研发,具备完整可评价的生物等效性数据的,也可用于注册申请。 |
药监局 | 7月13日 | 临床试验用药物生产质量管理规范(征求意见稿) | 规范临床试验用药物的生产。临床试验用药物应当遵循《药品生产质量管理规范》的通用原则,并根据临床试验期间药物的研究特点,以最大限度降低生产环节引入的风险,确保临床试验用药物质量,保障受试者的安全。 |
药监局 | 7月27日 | 关于调整药物临床试验审评审批程序的公告 | ①明确自受理缴费之日起60日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验;②申请人在获得首次临床试验许可后,应定期向药审中心提供药物研发期间安全性更新报告。 |
医保局 | 9月30日 | 关于将17种抗癌药纳入国家基本医疗保险、工伤保险和生育保险药品目录乙类范围的通知 | 17种抗癌药通过价格谈判进入国家医保目录,其中包括伊沙佐米、安罗替尼等2018年上市新药 |
药监局、卫健委 | 10月30日 | 关于临床急需境外新药审评审批相关事宜的公告 | ①在美国、欧盟或日本上市但未在我国境内上市的新药,用于治疗罕见病的药品;用于防治严重危及生命疾病,且尚无有效治疗或预防手段的药品;用于防治严重危及生命疾病,且具有明显临床优势的药品,组织开展品种遴选。②凡列入名单的,首次上市持证商认为不存在人种差异的,可提出上市申请;③药审中心建立专门通道开展审评,对罕见病治疗药品,在受理后3个月内完成技术审评;对其他境外新药,在受理后6个月内完成技术审评。 |
药监局 | 11月1日 | 关于发布第一批临床急需境外新药名单的通知 | 共计48个品种,可按照程序提交相关资料,直接提出上市申请 |
药监局 | 11月7日 | 关于优化优先审评申请审核工作程序的通知 | 对拟纳入优先审评的品种不再按批对外发布公示,调整为“即到即审”官网公示征求意见。 |
数据来源:公开资料整理
2018年,有关部门出台了系列加强药审部门与企业的沟通、加强知识产权保护的文件,创新药企研发效率提升、知识产权获得更好保护。对于创新药物、改良型新药、生物类似药、复杂仿制药等,明确就就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流,建立多种形式的沟通交流办法;对防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品加快审评审批并明确、缩短审评时限。同时,首次发布药品试验数据保护实施办法,对在中国境内获批上市的创新药给予6年数据保护期,创新治疗用生物制品给予12年数据保护期。对罕见病用药或儿童专用药,自该适应症首次在中国获批之日起给予6年数据保护期。发布关于加强药品审评审批信息保密管理的实施细则,维护药品注册申请人的合法权益,规范和加强审评审批信息保密管理,明确将13种情形视为泄露保密信息。
2018年加强沟通、加强IP保护重要政策文件回顾
发布机构 | 发布时间 | 文件 | 主要内容 |
药监局 | 3月11日 | 药品研发与技术审评沟通交流管理办法(修改稿) | ①适用于创新药物、改良型新药、生物类似药、复杂仿制药以及一致性评价品种等研发过程和注册申请中的沟通交流;②就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流;③规定的沟通交流会议适用于创新药物、改良型新药、生物类似药、复杂仿制药以及一致性评价品种等研发过程和注册申请中的沟通交流;④沟通交流的形式包括:面对面会议、视频会议、电话会议或书面回复。 |
药监局 | 4月26日 | 药品试验数据保护实施办法(暂行) | 对在中国境内获批上市的创新药给予6年数据保护期,创新治疗用生物制品给予12年数据保护期。对罕见病用药或儿童专用药,自该适应症首次在中国获批之日起给予6年数据保护期。 |
药监局 | 5月17日 | 关于加强药品审评审批信息保密管理的实施细则 | 维护药品注册申请人的合法权益,规范和加强审评审批信息保密管理,明确将13种情形视为泄露保密信息。 |
卫健委、药监局 | 5月23日 | 优化药品注册审评审批有关事宜的公告 | 对防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品加快审评审批。①建立与申请人之间的沟通交流机制,加强对药品研发的指导,对纳入优先审评审批范围的注册申请,审评、检查、审批等各环节优先配置资源,加快审评审批。②进口药品注册申请人经研究认为不存在人种差异的,可以提交境外取得的临床试验数据直接申报药品上市注册申请。③基于产品安全性风险控制需要开展药品检验工作,药审中心经评估认为无需检验的,不再通知开展检验工作;④取消进口药品再注册核档程序。 |
数据来源:公开资料整理
合理优化临床审批。临床试验从一次审批改为动态监管,创新药加速进入临床。2018年7月27日,药监局发布《关于调整药物临床试验审评审批程序的公告》,临床默许制正式实施,明确自受理缴费之日起60日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验,我们认为临床默许制大幅缩短了创新药进入临床的时间。同时,加强临床试验的监管和规范,包括临床试验药物生产的监管及明确在临床试验许可后,应定期向药审中心提供药物研发期间安全性更新报告。
2018年临床审批重要政策文件回顾
发布机构 | 发布时间 | 文件 | 主要内容 |
药监局 | 7月13日 | 临床试验用药物生产质量管理规范(征求意见稿) | 规范临床试验用药物的生产。临床试验用药物应当遵循《药品生产质量管理规范》的通用原则,并根据临床试验期间药物的研究特点,以最大限度降低生产环节引入的风险,确保临床试验用药物质量,保障受试者的安全。 |
药监局 | 7月27日 | 关于调整药物临床试验审评审批程序的公告 | ①明确自受理缴费之日起60日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验;②申请人在获得首次临床试验许可后,应定期向药审中心提供药物研发期间安全性更新报告。 |
数据来源:公开资料整理
2018年,国家卫健委、药监局进一步深化落实药审制度,为创新药的发展清扫“陈规旧律”,抓住重点,为创新药的加快发展提供了优化的制度环境。2017年10月,国务院办公厅下发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》从顶层设计角度对药审体制进行改革,标志着中国医药行业进入了属于创新药发展的黄金时期。而在《意见》下发后的一年中,我们也看到NMPA与国际接轨,大幅缩短海外新药在国内上市的审批时间,使患者得以享受更优越的治疗方式。另一方面,国内药企在政策扶持的激励下,也迸发出高昂的研发热情,研发投入不断提高,新药上市/临床申请数量也同比提高。
从NMPA审批速度来看,2018年新药上市优先审批数量同比大幅提高。2017年共152个新药申请和63个临床试验申请纳入优先审批,而2018年至10月底,已有223个新药上市申请和40个临床试验申请纳入优先审批。
2017-2018上市申请和临床申请优先审批数量

数据来源:公开资料整理
2018年创新药审评仍在加速。尤其是临床急需药物加速在中国上市,免疫治疗领域4个PD-1单抗获批上市,肿瘤治疗小分子抑制剂领域8个重磅小分子靶向药获批上市,丙肝领域3个DAA药物上市;除此之外,九价HPV疫苗、长效抗艾滋融合蛋白、聚乙二醇重组人粒细胞刺激因子获批上市。
2018年上市重磅新药回顾
药品名 | 研发企业 | 海外上市时间 | 国内上市时间 | 分类 | 适应症 | 潜在市场空间(亿元) |
信迪利单抗 | 信达生物 | -- | 2018年 | PD-1单抗 | 多种实体瘤及血液瘤 | 50 |
特瑞普利单抗 | 君实生物 | -- | 2018年 | PD-1单抗 | 多种实体瘤及血液瘤 | 50 |
纳武单抗 | BMS | 2014年 | 2018年 | PD-1单抗 | 多种实体瘤及血液瘤 | 50 |
帕博利珠单抗 | 默沙东 | 2014年 | 2018年 | PD-1单抗 | 多种实体瘤及血液瘤 | 50 |
安罗替尼 | 正大天晴 | -- | 2018年 | 多靶点抑制剂 | 抗肿瘤 | 50 |
吡咯替尼 | 恒瑞医药 | -- | 2018年 | HER2抑制剂 | HER2阳性乳腺癌 | 50 |
九价宫颈癌疫苗 | 默沙东 | 2006年 | 2018年 | 九价HPV疫苗 | HPV疫苗 | 30 |
仑伐替尼 | 日本卫材 | 2015年 | 2018年 | 多靶点抑制剂 | 抗肿瘤(肝癌) | 30 |
呋喹替尼 | 和记黄埔 | -- | 2018年 | 多靶点抑制剂 | 抗肿瘤(转移性结直肠癌) | 30 |
阿来替尼 | 罗氏 | 2015年 | 2018年 | ALK抑制剂 | ALK阳性非小细胞肺癌 | 30 |
奥拉帕利 | 辉瑞制药 | 2014年 | 2018年 | PARP抑制剂 | 卵巢癌 | 20 |
伊沙佐米 | 武田制药 | 2015年 | 2018年 | 可逆性蛋白体抑制剂 | 多发性骨髓瘤 | 10 |
索磷布韦维帕他韦 | 吉利德 | 2016年 | 2018年 | 丙肝DAA药 | 丙肝 | 10 |
艾尔巴韦格拉瑞韦 | 默沙东 | 2016年 | 2018年 | 丙肝DAA药 | 丙肝 | 10 |
艾博卫泰 | 前沿生物 | -- | 2018年 | 长效抗艾滋病毒 | 艾滋病 | 10 |
硫培非格司亭 | 恒瑞医药 | -- | 2018年 | 聚乙二醇重组人粒细胞 | 化疗引起的粒细胞减少 | 10 |
刺激因子 | ||||||
塞瑞替尼胶囊 | 诺华 | 2014年 | 2018年 | ALK抑制剂 | 非小细胞肺癌 | 10 |
丹诺瑞韦钠片 | 歌礼药业 | -- | 2018年 | 丙肝DAA药 | 丙肝 | 10 |
数据来源:公开资料整理
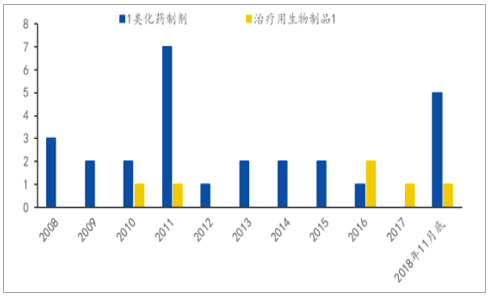
临床数据自查核查风波平息,国产新药2018年上市速度回暖。2016年以前卫健委实施旧的化学药品分类制度,对于新药的审查和临床疗效等审核要求不高,因此上市国产新药数量较多,但从药品适应症、临床疗效来说大多数品种价值并不大。由于国内药品临床管理落后,批件挤压等问题,2015年开始卫健委实行药品临床试验数据自查核查工作,大量药企在此风波中撤回药品申报批件,这也导致2015-2017年新获批的1类化药数量明显下滑,甚至2017年全年没有国产1类创新药获批。在经历临床数据自查核查风波和创新药新政改革后,2018年国产创新药市场重新迎来春天,重整旗鼓再出发,截止2018年11月底,共有5个国产1.1.类新药获批,获批数量创2012年来新高。更重要的是,从药品质量和疗效来说,也有巨大提升,标志着国内新药研发体系逐渐向欧美等发达国家靠拢。
2008-2018新上市的国产1.1类化药和1类生物制品数量
数据来源:公开资料整理
纵观历年获批国产新药,2018年是创新药发展的重要时间点。2011年之前,国内获批的1类新药主要以乙肝药物为主,并没有抗肿瘤药物,国内用药结构不合理。直至2011年,贝达药业首先推出肺癌靶向药物埃克替尼,尽管埃克替尼是国外抗癌药的改良药,对于国内创新药企业来说也是重要的突破,随后恒瑞医药在
2014年获批阿帕替尼,成为第二个获批的国产1类抗肿瘤药。而在2018年,共有3个肿瘤靶向小分子药物获批上市,这也标志着国内以抗肿瘤药物为主的创新药正式进入收获期。2018年12月17日,君实生物的PD-1大分子抗体药物完成审评审批,成为首个国产1类免疫药物。
药品名称 | 企业名称 | 获批时间 | 适应症 |
特瑞普利单抗注射液 | 上海君实生物医药科技股份有限公司 | 2018.12 | 黑色素瘤 |
呋喹替尼胶囊 | 和记黄埔医药(苏州)有限公司 | 2018.9 | 转移性结直肠癌 |
马来酸吡咯替尼片 | 江苏恒瑞医药股份有限公司 | 2018.8 | 复发或转移性乳腺癌 |
丹诺瑞韦钠片 | 歌礼药业(浙江)有限公司 | 2018.6 | 丙肝 |
注射用艾博卫泰 | 前沿生物药业(南京)股份有限公司 | 2018.5 | HIV-1 |
盐酸安罗替尼胶囊 | 正大天晴药业集团股份有限公司 | 2018.5 | 晚期非小细胞肺癌 |
苹果酸奈诺沙星胶囊 | 浙江医药股份有限公司新昌制药厂 | 2016.6 | 细菌感染 |
阿德福韦酯片 | 浙江贝得药业有限公司 | 2015.11 | 乙肝 |
西达本胺片 | 深圳微芯生物科技有限责任公司 | 2015.1 | 外周T细胞淋巴瘤 |
甲磺酸阿帕替尼片 | 江苏恒瑞医药股份有限公司 | 2014.1 | 晚期胃腺癌或胃-食管结合部腺癌 |
吗啉硝唑氯化钠注射液 | 江苏豪森药业股份有限公司 | 2014.3 | 细菌感染 |
帕拉米韦三水合物氯化钠注射液 | 广州南新制药有限公司 | 2013.4 | 抗病毒 |
注射用海姆泊芬 | 上海复旦张江生物医药股份有限公司 | 2013.1 | 鲜红斑痣 |
艾力沙坦酯片 | 上海艾力斯医药科技有限公司 | 2012.7 | 高血压 |
托伐普坦片 | 浙江大冢制药有限公司 | 2011.9 | 低钠血症 |
吡非尼酮胶囊 | 上海睿星基因技术有限公司 | 2011.9 | 特发性肺纤维化 |
赛洛多辛胶囊 | 第一制药(北京)有限公司 | 2011.8 | 前列腺增生 |
阿德福韦酯片 | 悦康药业集团有限公司 | 2011.8 | 乙肝 |
艾拉莫德片 | 先声药业有限公司 | 2011.8 | 风湿 |
盐酸埃克替尼片 | 浙江贝达药业有限公司 | 2011.6 | 晚期或转移性非小细胞肺癌 |
艾瑞昔布片 | 江苏恒瑞医药股份有限公司 | 2011.6 | 骨关节炎疼痛 |
阿德福韦酯片 | 河北医科大学制药厂 | 2010.11 | 乙肝 |
阿德福韦酯片 | 北京双鹭药业股份有限公司 | 2010.3 | 乙肝 |
盐酸安妥沙星片 | 安徽环球药业股份有限公司 | 2009.4 | 细菌感染 |
阿德福韦酯片 | 广东肇庆星湖生物科技股份有限公司 | 2009.3 | 乙肝 |
阿德福韦酯片 | 江苏天士力贝特制药有限公司 | 2008.6 | 乙肝 |
坎地沙坦酯胶囊 | 青岛国风高科技药业股份有限公司 | 2008.4 | 高血压 |
来氟米特片 | 大连美罗大药厂 | 2008.2 | 风湿性关节炎 |
艾普拉唑肠溶片 | 丽珠集团丽珠制药厂 | 2007.12 | 十二指肠溃疡 |
阿德福韦酯片 | 福建广生堂药业有限公司 | 2007.9 | 乙肝 |
数据来源:公开资料整理
国产靶向抗癌药市场空间巨大,政策扶持力度强。国产靶向抗癌药相对国外进口药物在价格上有较大的优势,上市以后放量迅速,埃克替尼总销售额从2011年的6千万迅速增长至2017年的10亿,而阿帕替尼在样本医院的销售额也从2016年的8千万增长至2017年的1.6亿元,2017年总体销售额约在14亿元。此外,相比进口靶向抗癌药,国产药物价格较低,也更容易进入医保覆盖范围,从而保障药品的迅速放量。
2011-2018H1埃克替尼总销售额
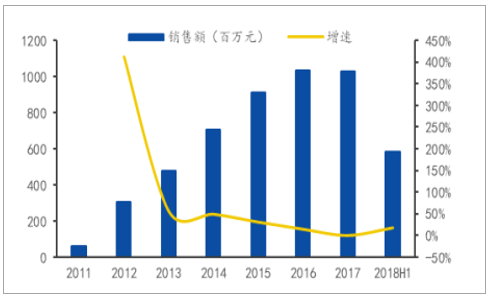
数据来源:公开资料整理
2016-2018单季度阿帕替尼样本医院销售额

数据来源:公开资料整理
国家谈判品种不纳入药占比考核,扫除放量障碍。11月29日,国家医保局等部委联合发布《关于做好17种国家医保谈判抗癌药执行落实工作的通知》。文中明确提到医保部门开展2018年医疗机构年底费用清算时,谈判药品费用不纳入总额控制范围,对合理使用谈判药品的费用要按规定单独核算保障。这也为抗癌药的销售清除了制度障碍,有利于抗肿瘤靶向药物的市场增长。
从获批的品种来看,小分子靶向抗癌药是主流品种。目前国内获批的五款靶向抗癌药均为小分子药物,主要原因是海外小分子药物品种相对成熟,国内企业可以通过“MeToo”或“MeBetter”的战略设计分子构型,研发相关产品,从而提高新药成功率。这对于创新药研发体系较弱的国产药物来说,是一条风险较为可控、收益较为可观的道路。
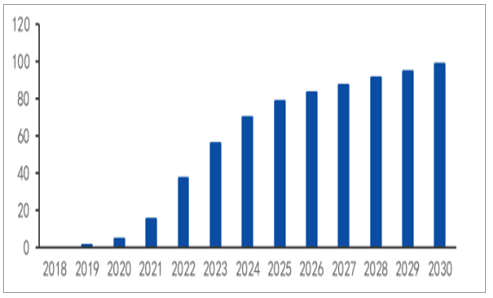
PD-1/PD-L1药物市场规模有望达到百亿规模。PD-1/PD-L1可以对多种肿瘤疾病产生效果,具有广谱的抗癌性质。随着适应症的不断扩大,其相应的市场规模也将不断增长。据测算,到2022年,国内PD-1/PD-L1的市场规模有望达到37.5亿元,而到2030年将接近100亿元。
2018-2030年中国PD-1和PD-L1市场规模预测(单位:亿元)
数据来源:公开资料整理
四款国产PD-1药物进入上市申请阶段,多家企业竞相研发PD-1/PD-L1药物。目前国产PD-1/PD-L1研发进入白热化竞争阶段,其中恒瑞医药、君实生物、信达生物和百济神州的四款PD-1药物均已提交上市申请,君实生物提交适应症为黑色素瘤,其余适应症均为霍奇金经典淋巴瘤。而处于二线梯队的PD-1/PD-L1产品也数量众多,包括沃森生物参股的嘉和生物、药明生物以及乐普生物控股的泰州翰中,目前临床进展也较为迅速。2018年12月17日,君实生物特瑞普利单抗完成审评审评,成为第一个获批上市的国产PD-1产品。
药品名 | 阶段 | 公司 | 靶点 | 适应症 |
卡瑞利珠单抗(SHR-1210) | 上市申请 | 恒瑞医药 | PD-1 | 霍奇金经典淋巴瘤等12个适应症 |
特瑞普利单抗(JS001) | 上市申请获批(黑色素瘤) | 君实生物 | PD-1 | 黑色素瘤等等12个适应症 |
信迪利单抗(IBI308) | 上市申请 | 信达生物 | PD-1 | 霍奇金经典淋巴瘤等5个适应症 |
替雷利珠单抗(BGB-A317) | 上市申请 | 百济神州 | PD-1 | 霍奇金经典淋巴瘤等7个适应症 |
杰诺单抗 | II期 | 嘉和生物 | PD-1 | B细胞非霍奇金淋巴瘤、腺泡状软组织肉瘤、复发和难治外周T细胞淋巴瘤(PTCL)等 |
GLS-010 | II期 | 药明生物&誉衡药业&ArcusBioscience | PD-1 | 复发或难治性经典型霍奇金淋巴瘤、晚期实体瘤(三阴性乳腺癌、肝癌、胃癌、食管癌) |
AK103/HX008 | II期 | 康方生物\杭州翰思\泰州翰中 | PD-1 | 黑色素瘤、胃和胃食管交界癌、微卫星高度不稳定或基因错配修复缺陷晚期实体瘤 |
AK105 | I/II期 | 康方生物 | PD-1 | 肝细胞癌、非小细胞肺癌、复发或难治性经典型霍奇金淋巴瘤 |
BAT1306 | I期 | 百奥泰 | PD-1 | 实体瘤 |
LZM009 | I期 | 丽珠生物 | PD-1 | 实体瘤 |
HLX10 | 批准临床 | 复宏汉霖 | PD-1 | 实体瘤 |
CS1003 | 批准临床 | 基石药业 | PD-1 | 实体瘤、淋巴瘤 |
人源化anti-PD1单抗 | 批准临床 | 神州细胞工程 | PD-1 | / |
F520 | 批准临床 | 山东新时代 | PD-1 | 晚期肿瘤 |
阿沐珠单抗 | 临床申请 | 思坦维 | PD-1 | - |
SG001 | 临床申请 | 尚健生物 | PD-1 | - |
SSI-361 | 临床前 | 安科生物/礼进生物 | PD-1 | - |
REMD-288 | 临床前 | 步长制药、RemdBiotherapeutics | PD-1 | - |
AK112 | 临床前 | 康方生物 | PD-1 | - |
JY034 | 临床前 | 东方百泰、精益泰翔 | PD-1 | - |
KN035 | III期 | 康宁杰瑞、思路迪 | PD-L1 | 结直肠癌、胆道癌、胃和胃食管结合部腺癌等 |
CS1001 | III期 | 基石药业 | PD-L1 | 非小细胞肺癌、复发或难治性结外NK细胞/T细胞淋巴瘤、经典型霍奇金淋巴瘤等 |
KL-A167 | II期 | 科伦药业 | PD-L1 | 复发或难治性经典型霍奇金淋巴瘤、结外NK/T细胞淋巴瘤(鼻型)和B细胞非霍奇金淋巴瘤等 |
ZKAB001 | I/II期 | 李氏大药厂 | PD-L1 | 骨肉瘤、尿路上皮癌、宫颈癌 |
SHR-1316 | I期 | 恒瑞医药 | PD-L1 | 小细胞肺癌、食管癌、晚期恶性肿瘤 |
MSB2311 | I期 | 迈博斯 | PD-L1 | 实体瘤 |
TQB2450 | I期 | 正大天晴、CBT | PD-L1 | 晚期恶性肿瘤 |
Pharmaceuticals | ||||
LP002注射液 | Ia | 泰州厚德(乐普医疗) | PD-L1 | 实体瘤 |
HLX20 | 批准临床 | 复宏汉霖 | PD-L1 | - |
BGB-A333 | 批准临床 | 百济神州 | PD-L1 | - |
HS636 | 批准临床 | 海正药业 | PD-L1 | - |
JS006 | 批准临床 | 君实生物 | PD-L1 | - |
全人源抗PD-L1抗体注射液 | 批准临床 | 白帆生物(桂林三金) | PD-L1 | - |
金纳单抗 | 临床申请 | 长春金赛 | PD-L1 | - |
REMD-290 | 临床前 | 步长制药、RemdBiotherapeutics | PD-L1 | - |
AK106 | 临床前 | 康方生物 | PD-L1 | - |
AK104 | 批准临床 | 康方生物 | PD-1/CTLA4 | - |
KN046 | 临床申请 | 康宁杰瑞、思路迪 | PD-L1/CTLA4 | - |
IBI315 | 临床前 | 信达生物 | PD-1/HER2 | - |
IBI318 | 临床前 | 信达生物 | PD-1/N.A. | - |
IBI319 | 临床前 | 信达生物 | PD-2/N.A. | - |
IBI322 | 临床前 | 信达生物 | PD-1/CD47 | - |
IBI323 | 临床前 | 信达生物 | PD-1/LAG3 | - |
Y111 | 临床前 | 友芝友 | PD-1/CD3 | - |
数据来源:公开资料整理
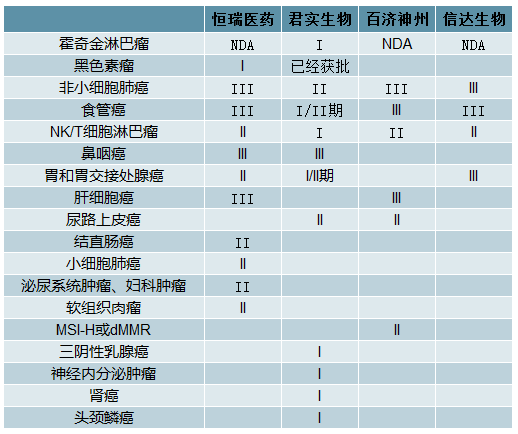
多适应症开拓市场空间,国产PD-1药物实行差异化临床布局。从进度最为领先的四个国产PD-1药物临床试验布局情况来看,在国内高发病种方面,四家企业均有所布局,并且临床进展较快,比如非小细胞肺癌、食管癌和胃癌等。而在发病率较低的癌症中,不同企业采取差异化道路,例如恒瑞医药在结直肠癌、小细胞肺癌和软组织肉瘤等病种上进展较快,君实生物则在三阴性乳腺癌、肾癌、神经内分泌肿瘤和头颈鳞癌等小病种上进行临床试验,百济神州和乐普生物的PD-1药物对于微卫星高度不稳定或基因错配修复缺陷晚期实体瘤也较为关注,而信达生物目前专注于几个大病种。
主要生产企业PD-1产品适应症情况
数据来源:公开资料整理
小分子靶向药爆发,8个品种获批上市
2018年小分子靶向药加速上市。其中包括3个多靶点抑制剂安罗替尼、仑伐替尼、呋喹替尼,2个ALK抑制剂阿来替尼、塞瑞替尼,1个HER2抑制剂吡咯替尼,1个蛋白酶体抑制剂伊沙佐米,1个PARP抑制剂奥拉帕尼。
正大天晴的安罗替尼是重磅品种之一。其首个适应症是非小细胞肺癌三线,临床数据显示其中位数无疾病进展生存期达到5.4个月,对照组仅1.4个月,中位数总生存期为9.6个月,对照组为6.3个月。安罗替尼在研适应症还包括软组织肉瘤、转移性结直肠癌、胃癌、肝细胞癌、肾癌等十余个癌种,2018年销售额预计超10亿元。
仑伐替尼是日本卫材研发的肝癌用药明星品种,也被誉为“更适合中国人的肝癌靶向药”。试验显示,仑伐替尼组患者的中位总生存期为13.6个月,对照组为12.3个月;中位无疾病进展生存期为7.4个月,对照组为3.7个月,中国人细分数据显示中位数总生存期为15个月,对照组为10.2个月。值得注意的是,默沙东与卫材公司仑伐替尼达成了深度合作协议,交易总额含里程碑费用达57.55亿美元,开展Keytruda与仑伐替尼的多个实体瘤适应症联用临床试验。
呋喹替尼原研公司是和记黄埔。首个获批适应症为转移性结直肠癌三线,在研适应症还有非小细胞肺癌、胃癌等癌种。转移性结直肠癌三线适应症临床数据显示,呋喹替尼组中位数总生存期和中位数无疾病进展生存期分别为9.3个月和3.7个月,对照组分别为6.57个月和1.8个月。
塞瑞替尼是诺华制药研发的二代ALK抑制剂。其中位数无疾病进展生存期达到16.7个月,显著优于一代的克唑替尼,阿来替尼是罗氏的重磅新药,IRC评估的中位数无疾病进展生存期达到25.7个月,研究者评估的中位数无疾病进展生存期高达34.8个月,阿来替尼有望成为ALK抑制剂重磅新药。
吡咯替尼是恒瑞医药研发新药。结构与PumaBiotech的来那替尼有一定相似性,但吡咯环的引入大幅改善了来那替尼的安全性问题,成为当前HER2小分子抑制剂同类最佳。在研适应症还包括联用赫赛汀用于乳腺癌维持治疗及乳腺癌术前新辅助。
伊沙佐米是蛋白酶体抑制剂,补充了中国多发性骨髓瘤患者的用药选择。临床数据显示复发难治多发性骨髓瘤患者中,伊沙佐米+来那度胺+地塞米松的试验组,PFS达到20.6个月,显著优于对照组(安慰剂+来那度胺+地塞米松)的14.7个月。且伊沙佐米是口服剂型,改变了传统蛋白酶体抑制剂需要频繁注射的现状。有望成为多发性骨髓瘤领域重磅新品。
丙肝DAA药物齐聚。包括吉列德的索磷布韦维帕他韦、默沙东的艾尔巴韦格拉瑞韦、歌礼药业的丹诺瑞韦钠片。索磷布韦维帕他韦在丙肝患者在治疗前无需再检测基因分型,治愈率(SVR12)高达92%-100%。艾尔巴韦格拉瑞韦片,用于治疗基因1、4型初治或经治复发慢性丙肝患者。达诺瑞韦钠片是歌礼药业研发的新一代NS3/4A蛋白酶抑制剂,在基因1型非肝硬化患者中治愈率(SVR12)达97%;在基因4型非肝硬化患者中的治愈率达100%。
其他领域重磅新品如默沙东的九价HPV疫苗、前沿生物抗艾滋长效药、恒瑞医药的长效升白,也有望成为重磅品种,九价HPV疫苗受益于存量需求爆发,有望快速放量,艾博卫泰凭借国产新药的身份、独特的给药方式及现有耐药市场的开发,有望占据一定市场份额。恒瑞医药的硫培非格司亭有望在化疗辅助领域快速推广。
展望未来两年,免疫治疗领域有多个PD-1/PD-L1有望上市,小分子靶向药领域多个ALK抑制剂、EGFR抑制剂、BTK抑制剂、NTRK抑制剂、PARP抑制剂、JAK1/2抑制剂有望上市,其中包括一批国产创新药竞争格局有望重塑。
2019年-2020年有望上市重磅新药展望
药品名 | 研发企业 | 海外上市时间 | 预计国内上市时间 | 分类 | 使用者 | 潜在市场空间(亿元) |
卡瑞利珠单抗 | 恒瑞医药 | -- | 2019年 | PD-1单抗 | 多种实体瘤及血液瘤 | 100 |
替雷利珠单抗 | 百济神州 | -- | 2019年 | PD-1单抗 | 多种实体瘤及血液瘤 | 100 |
巴瑞克替尼 | 礼来 | 2017年 | 2019年 | JAK1/2抑制剂 | 类风湿关节炎 | 20 |
赞布替尼 | 百济神州 | -- | 2019年 | BTK抑制剂 | 血液肿瘤多个适应症 | 10 |
氟马替尼 | 豪森制药 | -- | 2019年 | Bcr-abl抑制剂 | 慢粒白血病 | 10 |
Dacomitinib | 辉瑞制药 | 2018年 | 2019年 | EGFR抑制剂 | EGFR阳性非小细胞肺癌 | 10 |
恩沙替尼 | 贝达药业 | -- | 2019年 | ALK抑制剂 | ALK阳性非小细胞肺癌 | 10 |
布格替尼 | 武田制药 | 2017年 | 2019年 | ALK抑制剂 | ALK阳性非小细胞肺癌 | 10 |
艾维替尼 | 艾森医药 | -- | 2019年 | EGFR抑制剂 | EGFR阳性非小细胞肺癌 | 10 |
HLX-01 | 复宏汉霖 | -- | 2019年 | 美罗华生物类似药 | 弥漫大B细胞淋巴瘤 | 20 |
Secukinumab | 诺华制药 | 2015年 | 2019年 | IL-17A单抗 | 银屑病、强直性脊柱炎 | 10 |
Daratumumab | 强生制药 | 2015年 | 2019年 | CD38单抗 | 复发难治多发性骨髓瘤 | 10 |
聚乙二醇洛塞 | 豪森制药 | -- | 2019年 | 长效GLP-1 | 糖尿病 | 20 |
那肽 | ||||||
GV971 | 绿谷制药 | -- | 2019年 | Aβ捕获 | 阿尔茨海默症 | 20 |
Durvalumab | 阿斯利康 | 2017年 | 2019年 | PD-L1单抗 | 多种实体瘤 | 20 |
恩曲替尼 | 罗氏 | -- | 2020年 | ROS-1、ALK、NTRK抑制剂 | ROS-1/ALK阳性非小细胞肺癌,NTRK阳性肿瘤 | 30 |
Niraparib | Tesaro | 2017年 | 2020年 | PARP抑制剂 | 卵巢癌 | 20 |
Pamiparib | 百济神州 | -- | 2020年 | PARP抑制剂 | 卵巢癌 | 20 |
Vorolanib | 贝达药业 | -- | 2020年 | 多靶点抑制剂 | 抗肿瘤 | 20 |
拉劳替尼 | LOXO | 2018年 | 2020年 | NTRK抑制剂 | NTRK阳性肿瘤 | 10 |
Denosumab | 安进 | 2010年 | 2020年 | RANKL单抗 | 多发性骨髓瘤/实体瘤骨转移/骨质疏松 | 10 |
Ra223 | 拜耳制药 | 2013年 | 2020年 | 核药 | 前列腺癌 | 10 |
dichloride | ||||||
法米替尼 | 恒瑞医药 | -- | 2021年 | 多靶点抑制剂 | 抗肿瘤 | 20 |
数据来源:公开资料整理
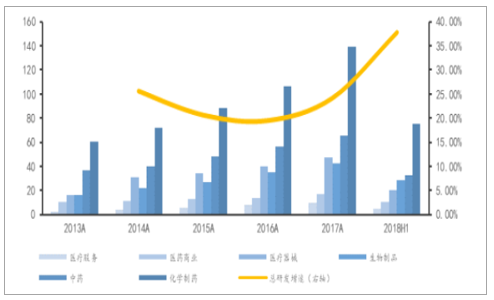
化药制剂板块由于新药研发支出较大,在所有板块中研发投入最高。综合对比不同板块,化学制剂的研发投入绝对值最大,2017年达139.0亿元,2018年上半年75.5亿元。行业总体研发费用提升增速较快,2013年到2017年复合增速达到22.51%,2018年上半年同比增长37.74%。
医药行业各版块研发支出(单位:亿元)
数据来源:公开资料整理
相关报告:智研咨询发布的《2019-2025年中国医药制造外包(CMO)行业市场深度调研及投资前景研究报告》
文章转载、引用说明:
智研咨询推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源(智研咨询)。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
智研咨询倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。



![2024年中国碳监测行业发展现状分析:碳监测市场正逐渐打开,多家企业布局 [图]](http://img.chyxx.com/images/2022/0408/1ba88a0bac4b4a65439b806124f6fc0f4ab03cad.png?x-oss-process=style/w320)
![2023年中国聚苯胺行业现状分析:行业规模稳步增长,新技术的研发推动行业进一步发展[图]](http://img.chyxx.com/images/2022/0408/55d853aceb464ffcf6fad7c27bbd7795797b1b5a.png?x-oss-process=style/w320)
![2023中国布鞋行业全景速览:定制化、跨界合作将是行业未来重要发展趋势[图]](http://img.chyxx.com/images/2022/0330/d1363a7ee3953fc25ed09e0b79158acce9dc7c22.png?x-oss-process=style/w320)
![2024年中国高强度聚焦超声(HIFU)行业全景洞察:随着技术不断改进和产业链不断完善,行业市场前景广阔[图]](http://img.chyxx.com/images/2022/0330/dd2a6e2dd1963d26c8672c625ba6166e69bd4120.png?x-oss-process=style/w320)
![2023年中国反刍动物饲料行业市场现状:需求推动下行业发展潜力较大,市场份额持续向优势企业集中[图]](http://img.chyxx.com/images/2022/0330/ff5315f651f3e124d0f5a156ac51655e46e5433f.png?x-oss-process=style/w320)
![2023年中国IT培训行业全景速览:传智播客、达内科技等知名品牌优势明显[图]](http://img.chyxx.com/images/2022/0330/6b296592ed87ae76d174b4fbc262ff18a3c189b8.png?x-oss-process=style/w320)