2015年11月国家食品药品监督总局发布了《关于开展仿制药质量和疗效一致性评价的意(征求意见稿)》,2016 年3 月国务院办公厅发文正式公布《关于开展仿制药质量和疗效一致性评价的意见》,仿制药一致性评价政策正式出台。2016年5月26日,CFDA发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号),作出了执行层面的明确部署:
289 目录 需要在2018 年底前完成 一致性评价 。凡2007年10月1日前批准上市的列入国家基本药品目录(2012版)中的化学药品仿制药口服固体制剂(共289个),原则上应在2018年底前完成一致性评价,其中需要开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成。其余品种限定在首家完成的三年内完成。对289个品种以外的化学药品仿制口服制剂,自第一家通过一致性评价后,三年后不再受理其他药品生产企业的同品种一致性评价申请。通过仿制药评价的品种,国务院要求医保和采购给以一定扶持。①社保部门在医保支付方面予以适当支持;②通过一致性评价的品种,医疗机构优先采购并在临床中优先选用;③同一品种达到3家以上通过一致性评价的,在集中采购方面不再选用未通过评选的品种。
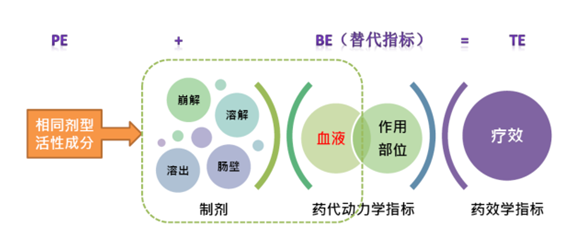
一致性评价的流程:主要包括 PE/BE 试验两个部分
“ 一致性”是指仿制药与原研药(或“参比制剂”)的治疗等效“治疗等效”又包含了两层含义,一是药学等效,是指同样的剂型要包含同样量的原料药,并符合同样的或法定的质量标准;另一个是生物等效(bioequivalent),是指具有同样的临床有效和安全性。仿制药 申请又称为 简化新药申请 ,通过简单的PE/BE 试验,从而免去大规模临床试验,最终实现可替换性。在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究:包括处方、质量标准、晶型、粒度和杂质等主要药学指标比较研究,以及固体制剂溶出曲线的比较研究,以提高体内生物等效性试验的成功率,并为将药品特征溶出曲线列入相应的质量标准提供依据。
治疗等效包括药学等效和生物等效
数据来源:公开资料整理
相关报告:智研咨询发布的《2017-2023年中国仿制药行业市场竞争态势及未来前景预测报告》
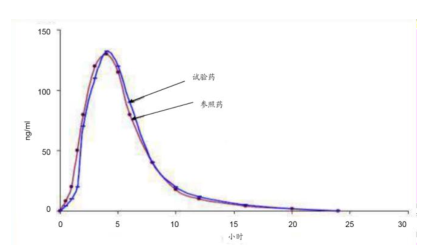
BE 试验:比照试验药和参照药的药代动力学曲线和血药浓度曲线生物等效性(BE)是指在相似的试验条件下单次或多次服用相同剂量的试验药物后,受试制剂中药物的 吸收速度和吸收程度与参比制剂的差异在可接受范围内。
BE试验是一致性评价的核心,是体内评价最重要的方法,须严格按照GCP要求开展。BE 试验 主要是比照试验药和参照药的药代动力学曲线 和 药品在服用后的血药浓度曲线。
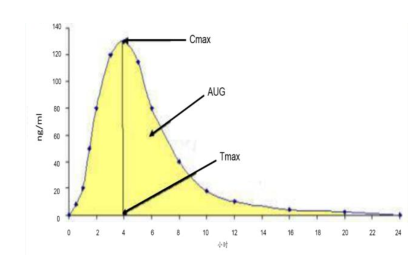
BE 试验的 主要终点是峰值和峰面积,对应的是C-max 和AUC。特殊情形下需要其他终点,比如改剂型导致药代动力学发生了比较大的变化,需要做临床等效性试验。
生物等效性的判定方法:通过单双侧t检验及置信区间法,得到试验药和参照药AUC和C max 几何均值比值的90%置信区间,此90%置信区间必须落在标准值的80%~125%范围内。
生物等效性比较
数据来源:公开资料整理
生物等效性BE 评价参数
数据来源:公开资料整理
一致性评价三个可以跟踪的节点:参比制剂备案,BE 备案,现场检查
一致性评价有三个重要节点: 参比制剂备案,BE 备案,现场检查,跟踪这三大节点可以具体判断出企业处于哪个阶段。
参比制剂备案。参比制剂报总局备案之后,企业就可以根据《普通口服固体制剂溶出曲线测定与比较指导原则》,比较仿制药和参比制剂的溶出曲线相似性。备案记录标志着企业进入了体外溶出的节点。
BE 备案。药品生产企业需要进行临床等效性试验的,需要登陆总局“化学药BE试验备案信息平台”,按要求填写备案信息,提交备案资料并获取备案号。BE备案情况标志着企业进入了生物等效性试验的最后阶段。
现场检查,一般是省局参与现场核查,意味着产品开始进入审批的最后阶段。
一致性评价的三个重要节点

数据来源:公开资料整理
一致性评价:单品种完整周期 32 个月,成本约 500 万元
一致性评价的标准审批需要32 个月:进入参比制剂备案后需要6-12个月时间才能进入BE备案,进入BE备案后需要6个月时间完成BE试验,完成现场检查后需要6-10个月的时间完成最终审批。
一致性评价的成本大概为500 万元:其中药学部分250万元,BE部分250万元,BE部分中医院分得125万元,CRO/生物分析分得125万元,预计CRO/生物分析单个试验盈利50-60万元。
一致性评价的成本:大约500 万

数据来源:公开资料整理
 智研咨询 - 精品报告
智研咨询 - 精品报告

2024-2030年中国仿制药一致性评价行业市场运行格局及发展前景研判报告
《2024-2030年中国仿制药一致性评价行业市场运行格局及发展前景研判报告》共四章,包含仿制药一致性评价对医药行业的影响分析,中国领先医药企业仿制药一致性评价发展分析,中国仿制药一致性评价市场前瞻与投资规划等内容。
文章转载、引用说明:
智研咨询推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源(智研咨询)。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
智研咨询倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。






